Привет.
2C6H5OH + K2O = 2C6H5OK + H2O
m(Фенол) = 200×0.08 = 16 грамм
n(Фенол) = 16/94 = 0.17 моль
Так как в полученном растворе был обнаружен только фенолят калия, значит фенол вступил в реакцию полностью.
Фенол и фенолят калия находятся в молярном соотношении 2 к 2.
Значит фенолята калия образовалось тоже 0.17 моль
n(C6H5OK) = 0.17 моль
m(C6H5OK) = 0.17 × 132 = 22.44 г
Фенол и оксид калия находятся а молярном соотношении 2 к 1, следует:
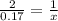
x= 0.085 моль оксида калия
m(K2O) = 0.085 × 94 = 8 грамм
Ищем массовую долю фенолята калия:
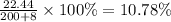
ответ: 10.78 %
C2H5COOH
Объяснение:
общая формула предельных одноосновных карбоновых кислот CnH2n+1COOH
Запишем уравнение реакции в общем виде:
0,25моль 0,25моль
CnH2n+1COOH + NaOH = CnH2n+1COONa+H2O
1моль 1моль
найдем моли гидроксида натрия по формуле n=m/M:
n(NaOH)=10г/40г/моль=0,25моль
Из уравнения реакции вдно, что кислоты вступило 0,25моль.Теперь найдем молярную массу кислоты по формуле M=m/n:
М(CnH2n+1COOH)=18,5г/0,25моль=74г/моль или
М(CnH2n+1COOH)=(14n+46)г/моль
14n+46=74
n=2 — следовательно молекулярная формула кислоты С2Н5СООН
1. FeS+O2=Fe+SO2
2. 2SO2+O2=2SO3 (скорее всего там SO3, а не SO)
3. SO3+H2O=H2SO4
4. H2SO4+BaCl2=BaSO4+2HCl