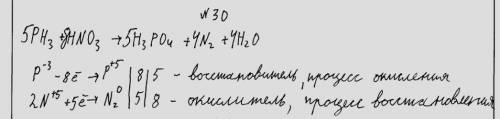
ответ:
теории кислот и оснований — совокупность - представлений, описывающих природу и свойства кислот и оснований. все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. все они имеют свою область применимости, каковые области частично пересекаются.
кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных дисциплинах.
на основе современной теории кислот и оснований разработаны такие разделы наук, как водных и неводных растворов электролитов, рн-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
C4H10O
Объяснение:
Надо найти соотношение количества веществ
количество вещества находится по формуле = массовая доля : молекулярная масса элемента (можно найти в таблице Менделеева )
n(C)= 64,9 : 12 = 5,408
n(H)= 13.5 : 1= 13,5
n(O)= 21.6 : 16 = 1,35
находим соотношение всех этих чисел(делим все числа на самое маленькое из них)
n(C):n(H):n(O)=5,408: 13,5: 1,35=4 : 10 :1
получается простейшая формула С4H10O
теперь находим молекулярную массу вещества умножая относительную плотность по водороду на молекулярную массу водорода (2)
37*2=74
проверяем соответствие молекулярной и простейшей формулы
4*12+10*1+16=74
74=74
ответ С4H10O
Объяснение:
Может ли быть вот такая реакция в егэ 30 номере?
5PH3+8HNO3=5H3PO4+4N2+4H20
В условиях прописано что должен выделиться газ (не указано какой) и образоваться кислота. Но изначально среди списка реагентов не было дано концентрации азотной кислоты, и в теории если учесть что она разбавленная, может же протекать такая реакция? Очень нужно знать, чтобы подавать апелляцию.
Фосфин - сильный восстановитель, азотная кислота - сильный окислитель
Во всех руководствах указывается, что при окислении неметаллов азотной кислотой последняя восстанавливается как правило до
NO2 (концентрированная) и до NO (разбавленная) - вот вам газы.
Фосфин при окислении дает вам ортофосфорную кислоту (вот вам кислота)
РН3 + 8НNO3 (k) = H3PO4 + 8NO2 + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║1
N⁺⁵ + 1e = N⁺⁴ восстановление, НNO3 (k) - окислитель ║8
3РН3 + 8НNO3 (р) = 3H3PO4 + 8NO + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║ 3
N⁺⁵ + 5e = N⁺² восстановление, НNO3 (р) - окислитель ║ 8
5РН3 + 8НNO3 (оч. р) = 5H3PO4 + 4N2 + 4H2O
кислота газ
P⁻³ - 8e = P⁺⁵ окисление, РН3 - восстановитель ║ 5
2N⁺⁵ + 10e = N₂⁰ восстановление, НNO3 (оч.р) - окислитель║ 4
Мне не суждено понять, почему вы выбрали последний вариант.
Если бы вместо фосфина был бы металл средней активности, то я бы смело вам сказал подавайте апелляцию. Но с фосфином ...
Теоретически вроде все верно. Но практически, быть может эта реакция протекает только при строго определенном рН или еще какие особые условия. С такой реакцией мне сталкиваться не приходилось. А вот с апелляцией дважды и оба раза мой ученик проиграл. Словом решать вам.