Полный сос!! Задача на вывод формулы. Массовые компоненты элементов в органічній речовині наступні: Карбон - 17,82%, Гідроген - 3%, а також міститься Бром. Відносна густина пари речовини за воднем 101. гомолога, 2 изомера
Хоть задача на украинскому, но я отвечу на русском. Надеюсь, что Вы поймёте.
Для начала найдём массовую долю брома: (100-17,82-3)%=79,18%
Для того, чтобы вывести эмпирическую(элементарную) формулу вещества, определим их соотношение:
Тогда, основываясь на вычислениях выше, составляем эмпирическую формулу:
Молекулярная масса данного вещества(эмпирического) равна:
Найдём молекулярную массу вещества, которое зашифровано через относительную плотность по водороду
Так как эмпирическая молекулярная масса совпадает с молекулярной массой конечного газа, то мы имеем право утверждать, что брутто-формула вещества следующая:
Под этой формулой может быть зашифровано несколько веществ:
1,2-дибромпропан
1,1-дибромпропан
1,3-дибромпропан
и т.д.
Нарисуем структурные формулы двух первых веществ(вложение):
Для составления формул бинарных соединений надо знать валентность или степень окисления составляющих элементов. На первых порах речь идет обычно о валентности. Оксиды. Валентность кислорода в оксидах всегда равна 2 (часто ее пишут римскими цифрами) . Предположим, вы хотите написать оксид меди. Предварительно надо знать что медь бывает двухвалентной (чаще) и одновалентной (реже) . Оксид двухвалентной меди CuO. Чтобы валентности обоих элементов были одинаковыми, потому что это число связей между ними (не будем уточнять тип связи) . Здесь у меди 2 и у кислорода тоже 2. Оксид одновалентной меди. Пишете сначала CuO, потом видите, что надо уравнять валентности. Для этого у меди надо поставить нижний индекс 2. Т. е. оксид Сu2O Общая валентность меди стала 2, как и у кислорода. Оксид алюминия. У него всегда валентность 3. Пишете AlO. Для уравнивания валентностей надо взять два атома алюминия и три атома кислорода. Тогда общая валентность алюминия будет 6, у кислорода - тоже 6. Формула Al2O3. Хлориды. Хлор в хлоридах всегда одновалентный. Хлориды олова Sn. Олово бывает двух- и четырехвалентным. Хлорид олова (II) SnCl2, хлорид олова (IV) SnCl4 Сульфиды. Сера в сульфидах двухвалентна. Составление формул сульфидов аналогично составлению формул оксидов. Сульфид железа (III) Fe2S3. Сульфид железа (II) FeS. Дополнение. Все сказанное не относится к соединениям, где атомы одного и того же элемента связаны между собой. Например, пероксид водорода Н2О2 . Структурная формула Н-О-О-Н. Здесь, несмотря на двухвалентность кислорода такая формула, потому что атомы кислорода связаны между собой. То же самое в бинарных органических соединениях, где атомы углерода образуют цепи и кольца.
Хоть задача на украинскому, но я отвечу на русском. Надеюсь, что Вы поймёте.
Для начала найдём массовую долю брома: (100-17,82-3)%=79,18%
Для того, чтобы вывести эмпирическую(элементарную) формулу вещества, определим их соотношение: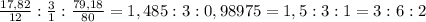
Тогда, основываясь на вычислениях выше, составляем эмпирическую формулу:
Молекулярная масса данного вещества(эмпирического) равна:
Найдём молекулярную массу вещества, которое зашифровано через относительную плотность по водороду
Так как эмпирическая молекулярная масса совпадает с молекулярной массой конечного газа, то мы имеем право утверждать, что брутто-формула вещества следующая: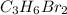
Под этой формулой может быть зашифровано несколько веществ:
1,2-дибромпропан
1,1-дибромпропан
1,3-дибромпропан
и т.д.
Нарисуем структурные формулы двух первых веществ(вложение):