Реакции, входящих в сплав металлов, с водой аналогичны: 2Na + H₂O = 2NaOH + H₂↑ 2K + H₂O = 2КOH + H₂↑ На два моля металла в обеих реакциях приходится моль водорода, занимающий при н.у объем 22,4л. Рассчитаем массы металлов в 8,5г сплава: из w = (mмет/mсплава)·100% найдем: mNa = 8,5г·54%:100% = 4,59г mК = 8,5г·(100%-54%);100% = 3,91г Mr(Na) = 23г/моль; ⇒масса 2 молей натрия: 46г; Составим и решим пропорцию: 46г Na 22,4л Н₂ 4,59гNa Хл Н₂ Х = 22,4л·4,59г :46г = 2,235л Н₂ Mr (К) = 39 г/моль; масса 2 молей К: 78г Составим и решим пропорцию: 78г К 22,4лН₂ 3,91гК У л Н₂ У = 22,4л·3,91г:78г = 1,123л Н₂ V(Н₂) = Х + У = 2,235л + 1,123л = 3,358л ≈3,36л Н₂ Можно не составлять такие пропорции, а найти, что 4,59г натрия = 0,2 моля и 3,91г К ≈ 0,1моля, и решить, что если при 2 молях натрия получается 1 моль водорода, ( аналогично, если при 2 молях калия получается моль водорода), то при 0,2 молей Na получится 0,1 моль Н₂, а при 0,1 моле К получится 0,05 моля Н₂. Всего Н₂ получится 0,15 моля, а это: 0,15 моля·22,4л/моль= 3,36 моля Н₂. При обоих естественно, получается один результат.
Получено 19,6 г сульфата хрома (III) Cr₂(SO₄)₃ и 3,36 л водорода
Объяснение:
Дано: m(Cr) = 5,2 г; m(H₂SO₄) = 98 г.
Найти: m(Cr₂(SO₄)₃); V(H₂).
Решение.
2Cr + 3H₂SO₄ → Cr₂(SO₄)₃ + 3H₂
По уравнению реакции хром и серная кислота реагируют в отношении 2 моль : 3 моль. Найдем количество вещества в заданных массах:
Молярная масса M(Cr) = 52 г/моль
Количество вещества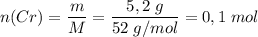 .
.
M(H₂SO₄) = 2 + 32 + 64 = 98 г/моль
На 0,1 моль Cr требуется 0,15 моль H₂SO₄. Серная кислота дана в избытке. Расчет ведем по хрому.
По уравнению реакции
n(Cr) : n(Cr₂(SO₄)₃) : n(H₂) = 2 : 1 : 3 = 0,1 моль : 0,05 моль : 0,15 моль
Найдем массу образовавшегося сульфата хрома (III) Cr₂(SO₄)₃
M(Cr₂(SO₄)₃) = 2*52 + 32*3 + 16*4*3 = 104 + 96 + 192 = 392 г/моль
m(Cr₂(SO₄)₃) = n*M = 0,05 моль * 392 г/моль = 19,6 г.
Найдем объем выделившегося водорода:
V(H₂) = n*Va = 0,15 моль * 22,4 л/моль = 3,36 л.