1) Дано.
m(р-раNa2SO4)= 142г.
w(Na2SO4)= 5%
Найти.
m(BaSO4)- ?
Решение.
Na2SO4+ BaCl2= BaSO4+ 2NaCl
142г.- 100%
mг.- 5%
m(Na2SO4)= 142г. ×5% ÷100%= 7,1г.
n= m/M
n(Na2SO4)= 7,1г. ÷ 142г/моль= 0,05моль
n(Na2SO4)= n(BaSO4)= 0,05моль
m(BaSO4)= 0,05моль× 233г/моль= 11,65г.
ответ. 11,65г.
2) Дано.
m(р-ра NaOH)= 160г.
w(NaOH)= 2%
Найти.
m(Na2SO4)- ?
Решение.
160г.- 100%
mг.- 2%
m(NaOH)= 160г.× 2% ÷ 100%= 3,2г.
2NaOH+ H2SO4= Na2SO4+ 2H2O
n(NaOH)= 3,2г÷ 40г/моль= 0,08моль
2n(NaOH)= n(Na2SO4)= 0,04моль
m(Na2SO4)= 0,04моль× 142г/моль= 5,68г.
ответ. 5,68г.
24 г 26,7 г, х г у г
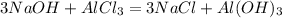
120 г 133,5 г 78 г
1. Сначала определим,какое из исходных веществ прореагирует полностью,т.е. без остатка,приняв,например,массу хлорида алюминия за Х:
для полного взаимодействия 120 г гидроксида натрия необходимо 133,5 г хлорида алюминия, а для --//-- 24 г______________________________х г, откуда
х=24*133,5/120=26,7 г
2. Так как все вещества прореагировали полностью,то массу осадка можно рассчитать по массе любого из исходных веществ:
при взаимодействии 120 г гидроксида натрия образуется 78 г осадка, а
при -- // -- // -- 24 г____________________________у г, откуда
у=24*78/120=15,6 г
24 г 26,7 г, х г у г
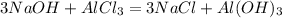
120 г 133,5 г 78 г
1. Сначала определим,какое из исходных веществ прореагирует полностью,т.е. без остатка,приняв,например,массу хлорида алюминия за Х:
для полного взаимодействия 120 г гидроксида натрия необходимо 133,5 г хлорида алюминия, а для --//-- 24 г______________________________х г, откуда
х=24*133,5/120=26,7 г
2. Так как все вещества прореагировали полностью,то массу осадка можно рассчитать по массе любого из исходных веществ:
при взаимодействии 120 г гидроксида натрия образуется 78 г осадка, а
при -- // -- // -- 24 г____________________________у г, откуда
у=24*78/120=15,6 г
Реакция взаимодействия между сульфатом натрия и хлоридом бария (Na2SO4 + BaCl2 = ?) относится к реакциям обмена. Это означает, что образуются два сложных соединения – две новые соли. Молекулярное уравнение реакции имеет вид:
\[Na_2SO_4 + BaCl_2 \rightarrow BaSO_4 + 2NaCl.\]
Запишем уравнение в ионном виде, однако, следует учесть, что образующийся сульфат бария является нерастворимым в воде соединением и, как следствие — не диссоциирует, т.е. не распадается на ионы.
\[2Na^{+} + SO_4^{2-} + Ba^{2+} + 2Cl^{-} \rightarrow BaSO_4 + 2Na^{+} + 2Cl^{-};\]
\[SO_4^{2-} + Ba^{2+} \rightarrow BaSO_4.\]
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (M(Na_2SO_4) = 142 g/mole; M(BaCl_2) = 208 g/mole):
\[n \rightarrow m \div M;\]
\[n (Na_2SO_4) \rightarrow m(Na_2SO_4) \div M(Na_2SO_4) \rightarrow 5,5 \div 142 \rightarrow 0,04 mole.\]
\[n (BaCl_2) \rightarrow m(BaCl_2) \div M(BaCl_2) \rightarrow 7,2 \div 208 \rightarrow 0,03 mole.\]
Это означает, что сульфат натрия находится в избытке и дальнейшие расчеты производим по хлориду бария.
Согласно уравнению реакции
\[ n(BaCl_2) : n(BaSO_4) = 1:1,\]
значит
\[n(BaSO_4) = n(BaCl_2) = 0,03 mole.\]
Тогда масса сульфата бария будет равна (молярная масса – 233 g/mole):