Не разбираюсь в 2 вариант 1) распределите по классам следующие соединения и дайте им названия: co2, sncl2, p2o5, fecl2, zno, agno3, mgso4, ba(oh)2, h2co3, fes, h2sio3, koh, h2so4, lioh, hj, al(oh)3, hgo, cuso4, h2o, caco3. 2) даны вещества: гидроксид кальция, раствор серной кислоты, оксид меди(ii), оксид кальция, оксид фосфора(v), гидроксид железа(iii). какие из этих веществ будут взаимодействовать между собой? напишите уравнения реакций и назовите образующиеся вещества. 3) как осуществить следующие превращения: s→so2→h2so3→k2so3 напишите уравнения реакций и укажите, к какому типу реакций относится каждая из них. 4)какое количество вещества(моль) и какая масса получится оксида меди(ii) из 49г. гидроксида меди(ii). 5)перед практической работой лаборант соляной кислотой снял с железного гвоздя образовавшиеся ржавчина, которая состоит из оксида железа(iii) и гидроксида железа(iii). запишите уравнения происходящих реакций. 3 вариант 1)распределите по классам следующие соединения, дайте им названия: h2s, na2sio3, so2, cuo, hclo4, p2o3, zn(oh)2, naoh, ca(no3)2, kcl, mg3(po4)2, cu(oh)2, na2o, hbr, cl2o7, fe2(so4)3, ba(oh)2, h3bo3, hgcl2, znco3. 2) даны вещества: цинк, раствор серной кислоты, оксид меди(ii), вода, гидроксид калия, оксид углерода(iv). какие из них будут взаимодействовать между собой? напишите уравнения реакций и назовите образующиеся вещества. 3)как осуществить следующие превращения: mg→mgo→mg(oh)2→mg3(po4)2 напишиет уравнения реакций, укажите её тип. 4) какое количество вещества(моль) и какая масса получится сульфата бария, если взято 9,8 г. серной кислоты реагирующей с барием. 5)почему реакцию нейтрализации гидроксида калия проводят в присутствии индикатора, а нейтрализацию гидроксида меди(ii)-без индикатора?
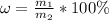

 грамм.
грамм.
№4:
Cu(OH)2 = CuO + H2O
n(Cu(OH)2) = 49/98 = 0,5 моль
Значит и оксида меди (II) получится 0,5 моль (см уравнение реакции), или 0,5*80 = 40 г