
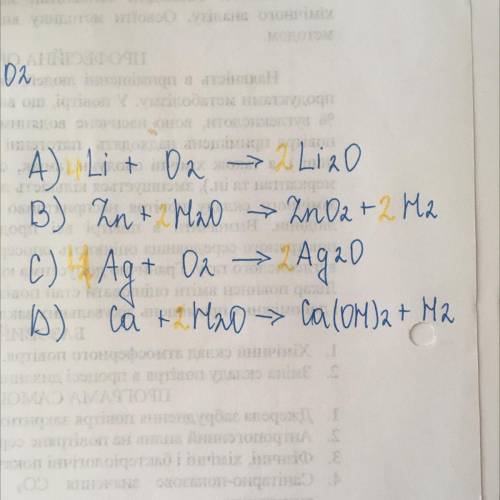
Объяснение:
Гомогенная смесь - однородная система, состоящая из одной фазы; гетерогенная смесь - система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно.
Примером гомогенной системы может служить любая газовая смесь (воздух), раствор нескольких веществ в одном растворителе, например, раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: в первом примере - из газовой фазы, во втором - из водного раствора. В качестве примера гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, растительное масло в воде, молоко и т.д.
Таким образом, гомогенная смесь - это однородная однофазная система. Особенностью гомогенной смеси является то, что между компонентами такой смеси не наблюдается поверхности раздела. Особенностью гетерогенной смеси является то, что мы можем наблюдать поверхность раздела между ее компонентами. При переходе из одной фазы компонента в другую его свойства резко изменяются. Гетерогенные смеси иначе называются дисперсные системы. Дисперсные системы состоят из дисперсионной среды (растворитель, непрерывная фаза) и дисперсной фазы (растворенного вещества или прерывистой фазы). К дисперсным системам относятся: - суспензии, смесь, состоящая из твердой и жидкой фазы (обозначение Т/Ж; Т- дисперсная фаза, Ж – дисперсионная среда) - эмульсии, смесь из 2-х и более несмешивающихся жидкостей (обозначение – Ж/Ж. Дисперсная фаза и дисперсионная среда жидкости различающиеся по плотности и температурам кипения).
2CuO + C = Cu2O + CO
или
СuO + С = Сu + СО
Объяснение:
Реакция оксида меди двухвалентного с углеродом проходит так, как указано в вопросе, однако можно встретить и менее типичную реакцию в некоторых источниках.
Это значит, что это не реакция ионного обмена, а окислительно-восстановительная реакция, в которой два вещества должны изменить степень окисления (один повысить, другой понизить).
Для примера: NaOH + HCl = NaCl + H2O - реакция ионного обмена.
CuSO4 + Fe = FeSO4 + Cu - Окислительно-восстановительная реакция, так как железо и медь поменяли степень окисления.
При ОВР должен выпасть осадок, выделится газ или вода.
Распишем нашу реакцию со степенями окисления:
2Cu²⁺O²⁻ + C⁰ = Сu2¹⁺O²⁻ + C²⁺O²⁻↑(угарный газ)
Аналогично:
Cu²⁺O²⁻ + C⁰ = Сu⁰ ↓(осадок)+ C²⁺O²⁻ ↑(угарный газ)
Теперь определим восстановитель и окислитель:
Медь имела заряд 2+, стала 1+ - понизила свою степень окисления, поэтому окислитель, но процесс восстановление.
Углерод имел заряд 0, а стал 2+ - повысил свою степень окисления, поэтому восстановитель, но процесс окисление.
Или
Медь имела заряд 2+, стала 0 - понизила свою степень окисления, поэтому окислитель, но процесс восстановление.
Углерод имел заряд 0, а стал 2+ - повысил свою степень окисления, поэтому восстановитель, но процесс окисление.
Составим запись по стандартам ОГЭ и ЕГЭ:
Сu²⁺ +1e(электрон) Cu¹⁺ - окислитель
C⁰ (-2е) C²⁺ - восстановитель
Или
Сu²⁺ +2e(электрон) Cu⁰ - окислитель
C⁰ (-2е) C²⁺ - восстановитель
Как находится число электронов?
Из степени окисления в левой части вычитаем степень окисления правой. Нужно проявить особую осторожность с такими веществами, как H₂, P₄, Cl₂ (и другими простыми с индексами), так как индекс меняет число электронов.
Зачем нам вообще это число электронов?
Оно уравнять реакцию. Число электронов у восстановителя ставим перед окислителем в левой части уравнения и наоборот.
Но если числа чётные - их необходимо сократить.
Правильность нашего уравнивания проверяем, считая количество вошедших и вышедших веществ:
На входе 2 меди, 2 кислорода и один углерод, на выходе: 2 меди, 2 кислорода и 1 углерод, следовательно, реакцию ионного обмена мы записали правильно.
Или
На входе: 1 медь, 1 кислород и один углерод, на выходе: 1 медь, 1 кислород и 1 углерод, следовательно, реакцию ионного обмена мы записали правильно.
Надеюсь, решение достаточно подробное.