а) 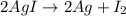 реакция разложения
реакция разложения
б) 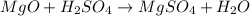 -реакция обмена
-реакция обмена
в) 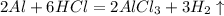 -реакциязамещения
-реакциязамещения
г) 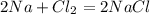 - реакция соединения
- реакция соединения
Объяснение:
Смешали два раствора, содержащих соответственно ортофосфорную кислоту количеством вещества 5 моль и гидроксид калия количеством вещества 18 моль. Определите количество вещества и массу образовавшейся соли, реакцию среды в растворе после реакции и массу одного из реагентов после реакции.
5 моль 15 моль 5 моль 3 моль
H3PO4 + 3KOH = K3PO4 + H2O + KOH (в остатке)
Сразу обратим внимание на количество вещества реагентов: гидроксида калия взято 18 моль, в реакцию вступит 15 моль, потому 3 моль гидроксида калия останется в растворе после окончания реакции. Масса КОН составит 56 г/моль х 3 моль = 168 г
Ортофосфат калия после реакции будет в растворе в количестве 5 моль. Молярная масса ортофосфата калия 212 г/моль и масса соли в растворе 212 г/моль х 5 моль = 1060 г. Реакция среды раствора после реакции будет щелочной рН > 7-8. В остатке щелочь КОН, кроме того сама соль в результате гидролиза образует ионы ОН(-)
1. ВаСi2 + K2SO4 = BaSO4 (выпадает в осадок) + 2KCi
m(BaCI2)=240*0,12=28,8г
n(BaCi2)=28,8г/208г/моль=0,138моль
n(BaSO4)=n(BaCi)=0,138моль
m(BaSO4)=0,138моль*233г/моль=32,154г
2. Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
n(Al2O3)= 52г/102г/моль=0,51моль
n(HNO3)=6n(Al2O3)=6*0,51=3,06моль
m(HNO3)= 3,06моль*63г/моль=192,78г
m(р-ра HNO3)=192,78г/0,2=963,9г
3. Zn + 2HCi = ZnCi2 + H2(газ улетучивается)
n(H2)= 5,6дм³/22,4дм³/моль=0,25моль
n(HCi)=2n(H2)=0,25моль*2=0,5моль
m(HCi)=0,5моль*36,5г/моль=18,25г
m(р-ра НСi)=18,25г/0,15=121,67г
а) 2AgI —> 2Ag+ I2
б) MgO + H2SO4 —> MgSO4 + H2O
в)2 Al + 6HCl —> 2AlCl3 + 3H2
г) 2Na + Cl2 —> 2NaCl