Дано:
m(H₂O) = 270 гр
m(Na₂CO₃ ⋅ 10H₂O) = 100 гр
Найти:
ω(Na₂CO₃) - ?
1) Для начала мы запишем уравнение реакций, теперь мы составляем пропорцию, при пропорций мы найдем массу карбоната натрия:
100 гр x - ?
Na₂CO₃ ⋅ 10H₂O (t°) → Na₂CO₃ + 10H₂O
1 моль 1 моль
286 гр/моль 106 гр/моль
2) Далее мы находим молекулярные массы карбоната натрия и кристаллической соды:
M(Na₂CO₃ ⋅ 10H₂O) = (23×2+12+16×3)+10×(1×2+16) = (46+12+48)+10×(2+16) = 106+10×18 = 106+180 = 286 гр/моль
M(Na₂CO₃) = 23×2+12+16×3 = 46+12+48 = 106 гр/моль
3) Мы составили пропорцию под пунктом 1), теперь мы находим массу карбоната натрия при пропорций:
x = 100 гр × 106 гр/моль / 286 гр/моль ≈ 100 гр × 0,3706 ≈ 37,06 гр ⇒ m(Na₂CO₃) = 37,06 гр
4) Теперь мы находим массу раствора, что бы найти массовую долю карбоната натрия:
m(р-ра) = m(H₂O) + m(Na₂CO₃ ⋅ 10H₂O) = 270 гр + 100 гр = 370 гр
5) Теперь мы находим массовую долю карбоната натрия при вот такой формуле:
ω(Na₂CO₃) = m(Na₂CO₃)/m(р-ра) × 100% = 37,06 гр / 370 гр × 100% ≈ 0,1 × 100% ≈ 10%
ответ: ω(Na₂CO₃) = 10%
Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
ответ: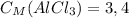 моль/л
моль/л