Тест 1. Для реакции 2Na + 2H2O = выберите продукты реакции:
а) = Na2O + H2
б) = 2NaOH + H2
в) = NaOH + H2O
г) = Na2O + H2O
2. Для реакции Zn + H2O = выберите продукты реакции:
а) = ZnO + H2
б) = Zn(OH)2 + H2
в) = ZnO + H2O
г) = Zn(OH)2 + H2O
3. Для реакции Cu + 2H2O = выберите продукты реакции:
а) = Cu2O + H2
б) = CuO + H2
в) = реакция не идёт
г) = СuO + H2O
4. Для реакции 2K + H2SO4 = выберите продукты реакции:
а) = K2SO4 + H2O
б) = K2S + H2O
в) = KOH + H2O
г) = K2SO4 + H2
5. Для реакции Au + 2HCl = выберите продукты реакции:
а) = реакция не идёт
б) = AuCl2 + H2
в) = AuCl2 + H2O
г) = AuCl3 + H2
6. Для реакции 2Al + 3CuSO4 = выберите продукты реакции:
а) = реакция не идёт
б) = Сu + Al2(SO4)3
в) = 3Сu + Al2(SO4)3
г) = 2Сu + Al2(SO4)3
7. Выберите электронную конфигурацию, которая соответствует иону Na+:
а) 1s22s22p63s1
б) 1s22s1
в) 1s22s22p63s23p6
г) 1s22s22p6
8. Составьте формулу методом нулевой суммы Fe+3O-2
Fe2O3
9. Найдите массовую долю меди в соединении CuSO4.
40%
10. Определите тип реакции
СuO + H2 = Cu + H2O
а) обмена
б) замещения
в) соединения
г) разложения
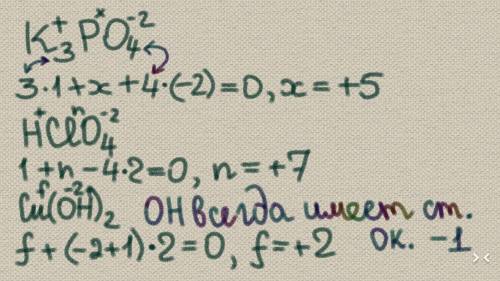
Объяснение:
1) б
2) а
3) в
4) Г
5) а
6) в
7) г
8) Fe(III)O(II) НОК = 6 Fe2O3
9) Mr(CuSO4) = 64 + 32 + 16*4 = 160
W(Cu) = Ar(Cu) *n / Mr(CuSO4) *100% = 64*1 / 160 *100% = 40%
10) б