
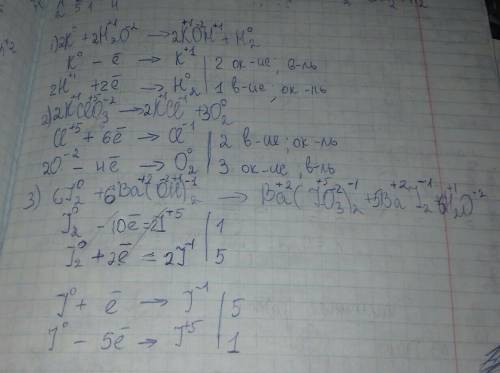

1.Взаимодействие металлов с водой.
При взаимодействии металлов с водой образуется гидроксид металла и водород.Как было написано в предыдущем ответе,можем выразить этот процесс схемой:
Me+H2O--->Me(OH)x+H2
(где "Me"-данный металл; "x"- индекс,зависящий от валентности металла).
Например:
а) Na - одновалентен
2Na+2H2O-->2NaOH+H2
б) Ca - двухвалентен
Ca+2H2O-->Ca(OH)2+H2
в) Al - трехвалентен
2Al+6H2О-->2Al(OH)3+3H2
2.Взаимодействие металлов с кислотами.
При взаимодействии металлов с кислотами образуется соль и водород. (Исключением является азотная кислота"HNO3",металлы не вытесняют водород из данной кислоты.В зависимости от концентрации азотной кислоты образуются:NO2;NO;N2O;N2. )
Например:
2Na+H2SO4-->Na2SO4+H2
Ca+2HCl-->CaCl2+H2
3.Взаимодействие с основаниями.
Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды(Al,Zn, Cr и др.)
2Al+2KOH+2H2O-->2KAlO2+3H2
Zn+2NaOH-->Na2ZnO2+H2
4.Взаимодействие металлов с солями.
При взаимодействии металла с солью образуется новая соль и металл. (Условие:металл,который мы добавляем к соли,должен быть более активным,чем металл,который находится в соли).
Например:
Zn+CuSO4--->ZnSO4+Cu
Fe+ СuSO4-->FeSO4+Cu
Елемент Літій міститься в 2-му періоді, у І групі, головній підгрупі. Символ елемента — Li. Назва простої речовини — літій.
2. Відносна атомна маса елемента Аг(ІА) = 6,9412.
3. Порядковий номер елемента (протонне число) — 3. Це число вказує на те, що до складу атома Літію входять 3 протони і 3 електрони.
Природний Літій складається з двох стабільних ізотопів: 6Li (7,5%) і 7Li (92,5%). Кількість нейтронів у ядрі нукліда 6Li дорівнює: 6 - 3 = 3, у ядрі нукліда 7Li дорівнює: 7 - 3 = 4.
4. Оскільки Літій міститься в 2-му періоді, то електрони в його атомі розташовані на 2-х енергетичних рівнях. Перший рівень заповнений; на ньому перебуває 2 електрони. На другому, зовнішньому, рівні міститься 1 електрон (кількість е для елемента головної підгрупи збігається з номером групи) — один електрон — на 2s-підрівні.
Електронна формула атома Літію — 1s2s1, або [He]2s1. Її графічний варіант (із позначенням заповнених s і вакантних 2р-орбіталей останнього енергетичного рівня) подано на схемі.