1) Рассчитаем кол-о в-ва NaOH: n = m/M = 4/40 = 0.1 моль;
2) для р-ии AlCl3 + 3NaOH = Al(OH)3 + 3NaCl с 0.03 моль AlCl3 требуется 0.03*3 = 0.09 моль NaOH, т.е. NaOH взят в изб., и первоначально образуется 0.03 моль Al(OH)3, а NaOH остается в кол-е 0.1-0.09 = 0.01 моль;
т.о. протекает р-ия NaOH + Al(OH)3 = Na[Al(OH)4], в которой из 0.01 моль NaOH и 0.01 моль Al(OH)3 образуется 0.01 моль Na[Al(OH)4], а Al(OH)3 остается в кол-е 0.03-0.01 = 0.02 моль;
3) по р-ии 2Al(OH)3 = Al2O3 + 3H2O из 0.02 моль Al(OH)3 будет получено 0.02/2 = 0.01 моль Al2O3 массой 102*0.01 = 1.02 г;
ответ C).
m(BaCl2* 2Н2О) = 56,3 ги m(Н2О) = 183,7 г.
Объяснение:
1)Найдем массу 200 мл. 20% раствора хлорида бария.
m(р-ра) = V*ρ = 200мл * 1,2 г/мл = 240г
2)Найдем массу растворенного вещества в 200 мл. 20% раствора хлорида бария.
ɷ =m(р.в.)/m(р-ра), m(р.в.) = 0,2* 240 = 48 г.
3)Найдем массу дигидрата хлорида бария
Для этого посчитаем молярные массы хлорида бария и дигидрата хлорида бария)
М(BaCl2) = 208г/моль
М(BaCl2* 2Н2О) = 244г/мольПересчитаем массу хлорида бария на дигидрат хлорида бария:
Для (BaCl2) 208г/моль – 48 г
Для (BaCl2* 2Н2О) 244г/моль – х г
Находим х: х= 244*48/208 = 56,3 г m(BaCl2* 2Н2О) = 56,3 г
4)Найдем массу воды:
m(Н2О) = m(р-ра) - m(BaCl2* 2Н2О) = 56,3 г= 240 – 56,3 = 183,7 г.
Второе
Объяснение:
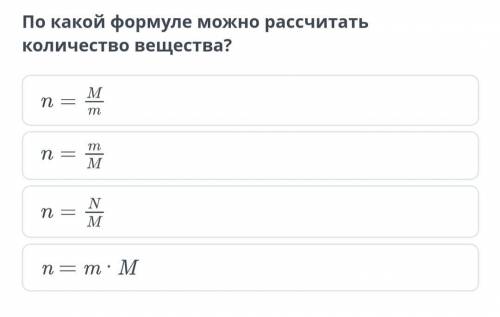
n=m/M
Количество вещества это отношение массы к молярной массе