
1.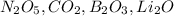
2. 4,7 г образца - это 100%, а
х г золота в нем___58,5%, откуда х=4,7*58,5/100=2,7 г
Чтобы определить количество вещества,то нужно массу поделить на молярную массу:
v(Au)=m(Au)/M(Au)=2,7/197=0,01 моль
3.
10 г, х г 20 г у г
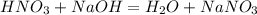
63 г 40 г 85 г
1. Сначала определим,какое из исходных веществ прореагировало полностью(без остатка),приняв одно из них за Х,например,масу кислоты:
для полной нейтрализации 63 г кислоты необходимо 40 г гидроксида, а
для --//--//-- х г___________________20 г, откуда х=63*20/40=31,5 г
2. Как видим,полностью прореагирует кислота,вот по ее массе и найдем массу соли:
при взаимодействии 63 г кислоты образуется 85 г соли, а
при --//--//-- 10 г_________________у г, откуда у=85*10/63=13,5 г
Уравнения реакций:
(1) CaC2 + 2H2O = Ca(OH)2 + C2H2
(2) Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Рассчитаем количество вещества газов:
n = V/Vm = 11,2л/22,4л/моль = 0,5моль
Пусть n(CaC2) = х моль
Пусть n(Al4C3) = у моль
Тогда, по уравнению реакции (1):
n(C2H2) = n(CaC2) = х моль
По уравнению реакции (2):
n(CH4) = 3n(Al4C3) = 3у моль
Составим уравнение:
х+3у = 0,5
Масса х моль CaC2: M*n = 64г/моль*хмоль = 64х
Масса у моль Al4C3: M*n = 144г/моль*умоль = 144у
Составим уравнение:
64х+144у=27,2
Составим систему:
х+3у=0,5
64х+144у=27,2
Домножим первое уравнение системы на 64:
64х + 192у = 32
64х + 144у = 27,2
Вычтем из первого руавнения второе:
48у = 4,8
у = 0,1
у - количество вещества Al4C3, рассчитаем, исходя из первогоуравнения х: 0,5 - 0,1*3 = 0,2 моль
Рассчитаем массы карбидов:
m(CaC2) = 64г/моль*0,2моль = 12,8г
m(Al4C3) = 144г/моль*0,1моль = 14,4г
Рассчитаем массовые доли:
w(CaC2) = 12,8/27,2*100% = 47%
w(Al4C3) = 100% - 47% = 53%