Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Реакция получается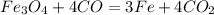
M(Fe3O4) = 232 г/моль
М(Fe) = 56 г/моль
V - ню
V = m : M
V(Fe3O4) = 108 кг : 232 г/моль 0,466
0,466
V(Fe) = 3 * V(Fe3O4) +3 * 0,466 1,398
1,398
m = V * M
m(Fe) = 1,398 * 56 г/моль 78 кг
78 кг
n (выход) = m(практ.)/m(теор.) * 100%
n = 63 кг : 78 кг * 100% 81%
81%
ответ: n = 81%