я надеюсь это то что ты хотел?)
Имеем: NH4Cl, (NH4)2SO4, NaCl, Na2SO4
Все соли растворимые(соли аммония и натрия растворимые априори)
Поэтому можем вести реакции в их растворах. Нужно первым делом отличить соли по катиону.
1) Проведём сначала нагревание. Видим следующее:
NH4Cl = NH3(газ) + HCl t = 340
(NH4)2SO4 = NH4HSO4 + NH3 t = 235—357°C
Соли аммония неустойчивы. Причём, как мы видим, 2 наши соли разлагаются при разных температурах по-разному. Соль сульфата аммония должна начать разлагаться раньше хлорида аммония. Хлорид аммония полностью разлагается на два газа, а соль сульфата аммония даёт газ и соль, которая плавится при 251 °С, кипит при 490°С.(гидросульфат аммония)
2) Хлорид и сульфат натрия отличаем по аниону: добавляем хлорид бария в обе пробирки:
Na2SO4 + BaCl2 = BaSO4(осадок) + 2NaCl
Сульфат бария выпадает в осадок.
25,6 г 24,6 г,х г у г
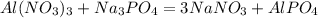
213 г 141 г 122 г
1. Определим,какое из исходных веществ прореагирует полностью(без остатка),приняв,например,массу фосфата натрия:
для полного взаимодействия 213 г нитрата алюминия необходимо 141 г фосфата натрия, а -- // -- 25,6 г____________________________х г, откуда
х=25,6*141/213=16,95 г
2. Как видим,что фосфат натрия дан в избытке,то расчет массы осадка ведем по массе нитрата алюминия:
при взаимодействии 213 г нитрата образуется 122 г фосфата алюминия,а
при -- // -- 25,6 г_________________у г, откуда
у=25,6*122/213=14,7 г
3. Чтобы найти количество вещества,необходимо сначала найти массу излишка,отняв от общей массы фосфата натрия массу,которая пошла на реакцию,т.е. 24,6-16,95=7,65 г
4. А теперь отнеся эту массу к молярной массе фосфата натрия,и получим количество вещества:
v(излишка)=m(излишка)/M(Na3PO4)=7,65/141=0,05 моль
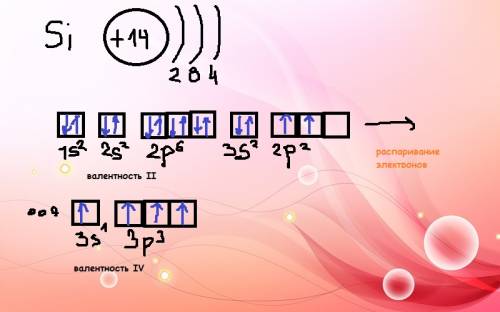
нормальное строение кремния соответствует валетному состоянию II, так как кремний на последнем энергетическом уровне имеет 2 неспаренных электрона (3р2). электроны с 3s2 перейдя на соседний подуровень 3р распариваются (становится 4 неспаренных электрона) и валентность кремния проявляется как IV.
Схемы во электронно-графического строения атома кремния и валентных состояний во вложении: