CuSO4 будет взаимодействовать с железом, цинком и алюминием, т.к. здесь будет происходить реакция замещения, происходящая только при условии, что простое вещество-металл более активен, чем металл в соли
 моль
моль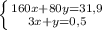
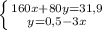

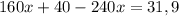

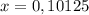 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)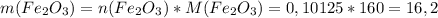 г
г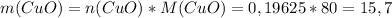 г
г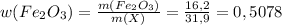 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)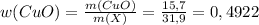 или 49,22%
или 49,22%
Сульфат меди будет взаимодействовать с железом и алюминием