Пробирки с содержимым разлить ещё на 2 части. В первый ряд пробирок добавляем лакмус, в той пробирке, в которой раствор приобретёт красный цвет - килота, в которой фиолетовый цвет - гидроксид, оставшаяся без изменений цвета пробирка - соль. Или можно во втором ряду прилить ко всем пробиркам соль серебра, в той которой выпадет белый осадок будет NaCl/
Cu(NO3)2 + Na2CO3 + 2H2O = 2NaNO3 + Cu(OH)2↓ + CO2↑
Объяснение:
Реакция между двумя растворимыми солями проходит, если продуктом является осадок, газ или неэлектролит.
Обе соли растворимы, следовательно реакция идет в растворе (вода H2O). Первая соль образована слабым основанием и сильной кислотой, а вторая сильным основанием и слабой кислотой - происходит совместный гидролиз солей.
Общий процесс можно представить так:Cu(NO3)2 - соль, образована слабым основанием и сильной кислотой, гидролиз по катиону:
Cu(NO3)2 + H2O ⇄ CuOHNO3 + HNO3
CuOHNO3 + H2O ⇄ Cu(OH)2 + HNO3
Na2CO3 - соль, образована сильным основанием и слабой кислотой, гидролиз по аниону:
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
NaHCO3 + H2O ⇄ H2CO3 + NaOH
Полученные вещества реагируют между собой, а также разлагается слабая угольная кислота:
NaOH + HNO3 = NaNO3 + H2O
H2CO3 ⇄ H2O + CO2
Відповідь:
Масова частка Оксигену у (ZnO)становить 19,75%,а в (CO)-57,14
Пояснення:
Масову частку знаходимо за формулою :
W(E)=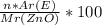
1)знайдемо молекулярну масу сполук ZnO і CO.
2)підставимо у формулу замість E-O,замість n-1(бо у сполуці оксиген один),замість Ar-16 і замість Mr-81 г/моль
отримаємо при цьому масову частку Оксигену у першій сполуці (19,75%)
в іншу підставимо замість E-O n-1(бо Оксиген один у сполуці),атомна маса Оксигену незмінна Ar-16,і молярна маса другої сполуки Mr-28 г/моль
Отримаємо що масова частка Оксигену у другій сполуці рівна (57,14%)
1) H2SO4 + Ba(OH)2 = BaSO4 (осадок белого цвета) + H2O
2) NH4Cl + NaOH = NH3 (газ) + NaCl + H2O
3) NaCl + AgNO3 = AgCl (творожистый осадок) + NaNO3