Задание №1 заполнить таблицу. Назвать вещества. Оксиды Основания Кислоты Соли
SO3, H2SiO3, CaSO4, Fe(OH)2, CaСl2, LiOH, H2SO4, Al2O3.
Задание №2. Составьте формулы солей по названию (обязательно указать валентность и НОК)
Сульфита меди (II), фосфата магния, силиката натрия, хлорида олова(II)
Задание №3 С какими из перечисленных веществ будет взаимодействовать водород: хлорид натрия, кислород , сера, оксид железа(II)Напишите уравнения химических реакций.
Задание №4 Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора?
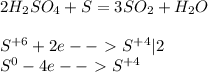
Общаться в чате
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Zn2+/Zn и E0Pb2+/Pb
E0Zn2+/Zn = -0.76 В
E0Pb2+/Pb = -0.126 В
Стандартная ЭДС гальванического элемента соответствует одномолярным концентрациям ионов Pb(2+) и Zn(2+), то есть когда [Pb(2+)] = [Zn(2+)] = 1 моль/л
В данной паре потенциал цинка имеет более отрицательное значение и является анодом. В тоже время свинец будет являться катодом.
На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла.
А: Zn0 -2e— = Zn2+
К: Pb2+ +2e— = Pb0
Zn0 + Pb2+ = Zn2+ + Pb0
Составим схему гальванического элемента:
(-) Zn0|Zn2+ || Pb2+|Pb0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EZn2+/Zn заданной концентрации:
E = E° + (0,059/n)lgC
EZn2+/Zn = -0.76 + (0,059/2)lg1 = -0.76 В
EPb2+/Pb = -0,126 + (0,059/2)lg1 = -0,126 В
Рассчитаем стандартную ЭДС реакции
ЭДС = Eкат — Eан = EPb2+/Pb — EZn2+/Zn
ЭДС = -0,126 – (-0.76) = 0.634 В
Растворяется цинк
Объяснение: