Задание 1:
1) Сложные вещества, состоящие из двух элементов, один из которых кислород - ОКСИДЫ
2) Сложные вещества, состоящие из разных по виду атомов химических элементов - СЛОЖНЫЕ ВЕЩЕСТВА
3) Вещества, состоящие из ионов металла и гидроксильных групп - ОСНОВАНИЯ
4) Вещества, состоящие из ионов металла и кислотных остатков - СОЛИ
5) Вещества-распознаватели кислот и щелочей - ИНДИКАТОРЫ
Задание 2:
1) в глаз попала кислота - промыть глаза большим количеством воды около 30 минут
2) если на кожу попала кислота - промыть большим количеством воды, после промыть раствором пищевой соды
3) ожог щелочами - промыть водой, после раствором лимонной, уксусной или борной кислоты
Задание 3:
А - 4
Б - 5
В - 1
Г - 2
Д - 3
Задание 4:
А. Лишнее Cu(OH)₂, потому что из всех перечисленных оснований оно единственное не растворимо в воде
Б. Лишнее LiOH, потому что из всех перечисленных оснований в этом основании единственный металл имеет степень окисления +1, когда все остальные +2
В. Лишнее Al(OH)₃, потому что из всех перечисленных оснований, во-первых, это нерастворимое, во-вторых, металл в нем имеет степень окисления +3, когда все остальные +1
Задание 5:
а) оксиды: CO₂ (оксид углерода (IV)), Al₂O₃ (оксид алюминия), Na₂O (оксид натрия)
б) основания: NaOH (гидроксид натрия или едкий натр), Fe(OH)₃ (гидроксид железа (III)), Ba(OH)₂ (гидроксид бария)
в) кислоты: HNO₃ (азотная кислота), H₂CO₃ (угольная кислота)
г) соли: K₂SO₄ (сульфат калия), Mg₃(PO₄)₂ (фосфат магния), CuCl₂ (хлорид меди)
Задание 6:
Формула: 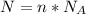 , где
, где 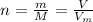 - количество вещества (моль);
- количество вещества (моль); 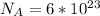 - число Авогадро (1/моль).
- число Авогадро (1/моль).
M - молярная масса (считается как сумма атомных масс элементов, входящих в вещество; атомные массы даны в таблице Менделеева)
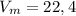 - молярный объем, одинаковый для всех газов при н.у. (л/моль)
- молярный объем, одинаковый для всех газов при н.у. (л/моль)
Считаем:
а) 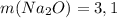 г
г
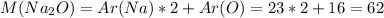 г/моль
г/моль
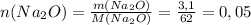 моль
моль
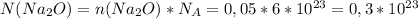 молекул
молекул
б) 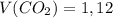 л
л
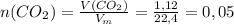 моль
моль
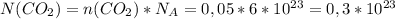 молекул
молекул
1. Из определения понятия «химический элемент» вытекает, что элемент сохраняется, пока сохраняется заряд ядер его атомов. Химический элемент превращается в новый элемент, если изменяется заряд ядер его атомов.
Атомы не вечны. Элементы с наивысшими порядковыми номерами самопроизвольно разрушаются в процессе радиоактивного распада, превращаясь в другие элементы. Выбрасываемые ими частицы в свою очередь могут вызывать превращение одних химических элементов в другие.
Для превращения одних элементов в другие в настоящее время используют не только потоки быстродвижущихся частиц, самопроизвольно выбрасываемых радиоактивными элементами. Подобные же потоки частиц разрушать ядра атомов и присоединишься к ним, получают и искусственно в особых установках. С их удалось осуществить сотни ядерных превращений и создать также разновидности атомов, которые в природе не обнаружены. Так были получены изотопы уже известных элементов: фосфора, кислорода и др. От существующих в природе изотопов этих элементов новые, искусственно полученные изотопы отличаются не только атомным весом, но и сильной радиоактивностью. Поэтому они и не сохранились в природе.
2. Изото́пы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа.
3. Изото́пы водоро́да — разновидности атомов химического элемента водорода, имеющие разное в ядре число нейтронов. На данный момент известны 7 изотопов водорода. Самые известные: протий ₁¹H, дейтерий ₁²H, тритий ₁³H.
Помимо них, существуют четыре искусственно синтезированных изотопа: квадий, пентий, гексий и септий. Характеризуются данные разновидности чрезвычайной нестабильностью, время жизни их ядер выражается величинами порядка 10-22 – 10-23 секунд.
2СхHyN+O2= CO2+H2O+N2
n(N2)=5.2/22.4=0.23 моль
М(СxHyN)=15.5/0.46=33.7
12x+y+14=33.7
12x+y=19.6
=> СH5N