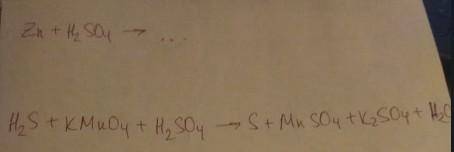
1. живую природа на планете нуждается в охране и от людей. но тем ни менее где ценят живую природу там она радует глаз людям. ведь очень приятно прогуляться по улице с цветами деревьями и животными. но и живая природа в свою очередь и нам.
2. мой край багат своими животными, растениями, птицами и ископаемыми. но к созданию многие из них нуждаются в охране и занесены в Красную книгу России.
3. в моем крае животным не совсем хорошо. потому что люди мусорят дороги и не раз бывали случаи когда от этого погибали и животные и растения. а охраняет мой край растений и животных так:
строит заповедники
сортирует мусор
сдают макулатуру
собирают батарейки и отдают их в специальное отделение и т. д.
Zn + H2SO4 → ZnSO4 + H2
5H2S + 2KMnO4 + 3H2So4 → 5S + 2MnSo4 + K2So4 + 8H2O
Объяснение: