2Ca + O2 = 2СаO
CaO+H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2O
Ca(NO3)2 + BaCO3 = CaCO3 +Ba(NO3)2
металл - оксид - гидроксид - нитрат (соль) - карбониат (соль)
В певром превращении у кальция и кислорода по отдельности степень окисления равны по нулю. В оксиде кальция степень окисления у кислорода равна -2 , а у кальция +2. Следовательно, кислород "отобрал" у кальция два электрона и поменял степень окисления с большую на меньшую. Кислород - ОКИСЛИТЕЛЬ. А кальций - ВОССТАНОВИТЕЛЬ
Ca(2+)+2NO3(-) + Ba(2+)+CO3(2-) = CaСО3 +Ba(2+)+ 2NO3(-)
Сa(2+)+ CO3(2-) =CaCO3
В реакции образуется осадок карбонат кальция, который не является электролитом и не распадается на ионы
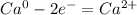 2 восстановитель
2 восстановитель 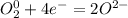 окислитель
окислитель 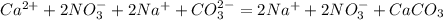
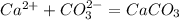
5 л = 5000 мл
1) Находим массу 25%-ного раствора кислоты:
m = ρ*V = 1,142*5000 = 5710 г
2) Если концентрацию раствора выразить в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах,
ω - массовая доля растворенного вещества, выраженная в долях единицы.
25% - это 0,25 в долях единицы, а 95% - 0,95
3) Обозначим массу 95%-ного раствора через Х граммов.
При добавлении воды масса растворенного вещества не изменяется.
На основании всего вышеизложенного составляем уравнение:
0,25*5710 = 0,95*Х
0,95Х = 1427,5
Х = 1502,6 г