Задача 1.
х г у г 22 г
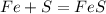
56 г 32 г 88 г
1. При взаимодействии 56 г железа образуется 88 г сульфида, а
при --//--//--//-- х г__________________22 г, откуда
х=56*22/88=14 г
2. При взаимодействии 32 г серы образуется 88 г сульфида, а
при --//--//--//-- у г________________22 г, откуда
у=32*22/88=8 г
Задача 2.
13 г х г у г
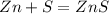
65 г 32 г 97 г
1. Для полного взаимодействия 65 г цинка необходимо 32 г серы, а
для --//--//--//--//--//-- 13 г_________________х г, откуда
х=13*32/65=6,4 г
2. При взаимодействии 65 г цинка образуется 97 г сульфида, а
при --//--//--//--//-- 13 г________________у г, откуда
у=97*13/65=19,4 г
1) Me(OH)2 и MeSO4 - т.к. ОН имеет валентность 1 (степень окисления 1-) то металл имеет валентность 2; кислотный остаток SO4 имеет валентность 2 (или же степень окисления 2-)
Примеры: Cu(OH)2, BaSO4
2) Me2CO3 и MeCO3 - как минимум потому, что тут при одном и том же кислотном остатке металл и двухвалентный, и одновалентный, мы можем отбросить эту пару
3) MeS и MeI3 - кислотный остаток S имеет валентность 2 (или же степень окисления 2-), однако т.к. кислотный остаток I одновалентный, то значит в формуле нужен трёхвалентный металл (например Al), а значит эта пара нам не подходит
4) MeS и MeCO3 - кислотный остаток S имеет валентность 2 (или же степень окисления 2-), так же и с CO3
Примеры: CuS, MgCO3
5) MeCl2 и Me(NO3)2 - такая же ситуация: кислотные остатки Cl и NO3 имеют валентность 1 (степень окисления 1-)
Примеры веществ: CaCl2, ZnNO3
Верные утверждения 1,4,5