Вычислим молярную массу исходного вещества:
М = D(H2)*2 = 16*2 = 32 г/моль
Найдем количества вещества продуктов реакции и исходного вещества:
Исходное вещество: n = 4,8/32 = 0,15 моль
Углекислый газ: n(CO2) = 3,36/22,4 = 0,15 моль
Вода: n(H2O) = 5,4/18 = 0,3 моль
Согласно формуле в одном моле углекислого газа содержится один моль углерода, т.о. в 0,15 моль газа содержится 0,15 моль углерода
Согласно формуле в одном моле воды содержится 2 моля водорода, т.о. в 0,3 моль воды содержится 0,6 моль водорода.
Следовательно, 0,15 моль исходного вещества содержит 0,15 моль углерода и 0,6 моль водорода.
Приводим к целым числам:
1 моль исходного вещества - 1 моль углерода + 4 моль водорода.
Проверка: 1*12 + 4*1 = 16 г/моль. Полученное значение меньше найденной ранее молярной массы вещества, следовательно, в молекулу вещества входит также кислород
Находим количество вещества кислорода в молекуле:
(32 - 16)/16 = 1
Таким образом, формула исходного вещества СН4О
Данное вещество относится к гомологическому ряду предельных одноатомных спиртов
ответ: СН3ОН, предельный одноатомный спирт
Объяснение:
а) Hg + S = HgS
Hg(0) - 2е = Hg(+2) окисление, Hg - восстановитель ║1
S(0) +2 e = S(-2) восстановление, S - окислитель ║1
б) 2NaNO3 = 2 NaNO2 + O2
N(+5) + 2e = N(+3) восстановление, NO3(-) - окислитель ║2
2O(-2) - 4e = O2(0) окисление, 2O(-2) - восстановитель ║ 1
в) CuSO4 + NaOH = Na2SO4 + Cu(OH)2 - это не ОВР, атомы всех элементов не изменили своих степеней окисления.
г) 3 K2MnO4 +2 H2O = 2 KMnO4 + MnO2 +4 KOH
Mn+6 - 1e = Mn+7 окисление ║2
Mn+6 + 2e = Mn+4 восстановление ║1
K2MnO4 в реакции выполняет роль одновременно и восстановителя и окислителя
д) CaH2+ 2H2O = Ca(OH)2 + 2H2
2 Н(-1) - 2е = Н2(0) - окисление, CaH2 - восстановитель ║1
2 H2O + 2e = 2OH(-) + H2 восстановление - Н2О - окислитель║1
е) 2 As + 5 Cl2 + 8H2O = 2H3AsO4 + 10 HCl
As (0) - 5e = As(+5) окисление, As - восстановитель ║ 2
Cl2 (0) + 2e = 2Cl(-) восстановление Cl2 - окислитель ║ 5
ж) 6 FeCl2 + KClO3 + 6HCl = 6 FeCl3 + KCl + 3H2O
Fe(+2) - e = Fe(+3) окисление, Fe(+2) - восстановитель ║ 6
Cl (+5) + 6e = Cl(-) восстановление KClO3 - окислитель ║1
з) NO2 + H2O = HNO3 + NO
Обычно уравнение получения азотной кислоты из диоксида азота записывалось так:
4 NO2 + 2H2O + О2= 4 HNO3
з) 3 NO2 + H2O = 2HNO3 + NO
N(+4) - e = N(+5) oкисление NO2 - восстановитель ║2
N(+4) +2e = N(+2) восстановление NO2 - окислитель ║ 1
Очень интересный вариант ОВР : из трех молекул диоксида азота - две окисляются и одна - восстанавливается.
и) Al(OH)3 = Al2O3 + H2O - это не ОВР, атомы всех элементов не изменили своих степеней окисления.
к) H2O + P2O5 = H3PO4 - это не ОВР, атомы всех элементов не изменили своих степеней окисления.
л) Fe + 2HCl = FeCl2 + H2
Fe(0) - 2е = Fe(+2) окисление, Fe - восстановитель ║1
2Н+ + 2е = Н2(0) - восстановление, 2Н+ - окислитель║1
м) 4Cr(NO3)3 = 2Cr2O3 + 12 NO2 + 3O2
N(+5) + e = N(+4) восстановление ║ 4
2O(-2) + 4 = O2(0) окисление ║ 1
н) 2 KMnO4 + 3NaNO2 + H2O = 2 MnO2 + 3NaNO3 + 2KOH
Mn(+7) +3e = Mn(+4) восстановление KMnO4 - окислитель ║2
N(+3) - 2e = N(+5) окисление, NaNO2 - восстановитель ║3
о) K2Cr2O7 + HBr = Cr2Br3 + KBr3 + 7H2O
Опечатка в уравнении реакции. Следует читать
о) K2Cr2O7 + 14HBr = 3Br2 + 2CrBr3 + 2KBr + 7H2O
Сr2(+6) + 6e = Сr2(+3) восстановление ║ 1
2Br(-) - 2e = Br2 окисление ║3
п) 5 Mg + 12 HNO3 = 5 Mg(NO3)2 + N2↑ + 6H2O
Mg(0) - 2e = Mg(+2) окисление ║ 5
2N(+5) + 10 = N2 восстановление ║ 1
р) 3CuO + 2NH3 = 3Cu + N2 + 3H2O
Сu(+2) +2e = Cu(0) восстановление ║3
2N(-3) - 6e = N2(0) окисление ║1
Объяснение:
Так, тут потруднее будет... Давай разбираться!) Мы её решим:) И так, у нас с тобой есть раствор NaOH и кусок металла (Na). Первое что мы делаем по условию, это кидаем натрия в данный раствор и наблюдаем бурную реакцию. Дело в том, что ключевое слово в данной задачи - это раствор, а раствор = растворитель (в данном случае вода) + растворённое вещество (NaOH). Так вот, ясно, понятно, что натрий реагировать с NaOH не будет, поскольку основный металл + щелочь = реакция не идёт. Значит, натрий прореагирует с водой, с образованием той же щёлочи NaOH, а значит масса растворённого вщества будет больше, т.е образуется определённая масса NaOH, которая в сумме с уже растворённым веществом даёт новую массу. Либо, новое количество вещества. Так вот!))) Смотри:
Дано:
mр-ра(NAOH) = 200 г.
W(NaOH) = 10% = 0,1
m(Na) = 46 г.
V(CO2) = 11,2 л.
Найти:
W%(Na2CO3) - ?
(1)
1) n1(NaOH) = n(Na) = (Na) : M(Na) = 46 г : 23 г/моль = 2 моль;
2) n2(NaOH) = (mр-ра(NaOH) * W(NaOH)) : M(NaOH) = 200 г. * 0,1 : 40 г/моль = 0,5 моль;
3) n3(NaOH) = n1(NaOH) + n2(NaOH) = 2 моль + 0,5 моль = 2,5 моль;
4) n(CO2) = V(CO2) : Vm = 11,2 л. : 22,4 л/моль = 0,5 моль;
5) n(NaOH) : n(CO2) = 2,5 : 0,5 = 5 : 1 => n(NaOH) - в избытке, а значит образуется средняя соль - Na2CO3 (Карбонат Натрия). Таким образом, расчёты ведём по недостатку, т.е по n(CO2):
(2)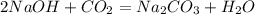
n(Na2CO3) = n(CO2) = 0,5 моль;
m(Na2CO3) = n(Na2CO3) * M(Na2CO3) = 0,5 моль * 106 г/моль = 53 г.
6) mр-ра = mр-ра(NaOH) + m(Na) - m(H2) + m(CO2) = 200 г + 46 г - 2 г + 22 г = 266 г.;
7) W%(Na2CO3) = m(Na2CO3) : mр-ра * 100% = 53 г. : 266 г. * 100% = 20%.
ответ: W%(Na2CO3) = 20%.