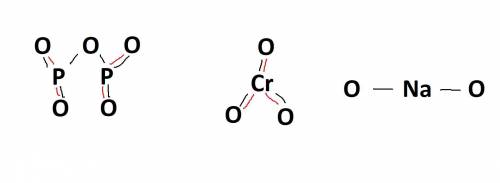
1) P2O5 - 4
2) CrO3 - 3
3) Na2O - 0
Объяснение:
Для того, чтобы считать кол-во пи-связей, надо знать структурную формулу молекулы. Если она дана(известна), то следует обратить внимание на те "линии"(связи), которыми соединены атомы. Если все атомы соединены одной "линией"(связью) друг с другом, значит, пи-связей нет (например, метан(и прочие алканы) - наглядный пример). Если где-то атомы соединены более чем одной связью("линией"), то надо считать уже в тех(том) местах(месте), где больше чем одна связь образуется, кол-во "лишних" связей.
Т.е. H3C-CH3 (0 пи-связей); H2C=CH2 (1 пи-связь); CH≡CH (2 пи-связей).
Как-то так : )
Для начала массу раствора 100 мл 96%-ного раствора найдём по формуле:
m(p-pa) = p * V, получим:
m(p-pa) = 1,84 * 100 = 184 г.
Массу сульфатной кислоты в данном растворе находим по формуле:
w = m(в-ва) * 100%/m(р-ра), тогда:
m(H2SO4) = m(р-ра) * w/100 = 184 * 96/100 = 176,64г
Рассчитаем массу раствора полученного при смешении 100 мл 96%-ного раствора с 400 мл воды, получим:
m(p-pa) = (100 + 400) * 1,220 = 610 г.
Определим молярную массу эквивалента (H2SO)4 из соотношения:
MЭ(B) = M(B)/Z(B), где:
MЭ(В) - молярная масса эквивалента кислоты, г/моль;
М(В) - молярная масса кислоты;
Z(B) - эквивалентное число.
Значит:
M(H2SO4) = M(H2SO4)/Z(H2SO4) = 98/2 = 49 г/моль
Тогда эквивалентную концентрацию раствора найдём по формуле:
C2(H2SO4) = 176,64*1000/49*500 = 7,2н
Рассчитаем массовую долю полученного раствора:
w = 174,64*100/610 = 28,96% = 0,2896
ответ: 7,2н; 28,96%.