Объяснение:
Сначала напишем уравнение реакции:
Zn + 2HCl = ZnCl₂ + H₂↑
Так как дана масса цинка, мы можем рассчитать его моли:
n(Zn) =  =
= 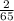 = 0,03 моль. (Молярную массу цинка нашли в таблице Менделеева).
= 0,03 моль. (Молярную массу цинка нашли в таблице Менделеева).
Теперь найдём моли водорода. Так как цинк и водород находятся в равных соотношениях, что видно по уравнению реакции, то моли водорода будут равны молям цинка:
n(H₂) = n(Zn) = 0,03
V(H₂) = n×Vm = 0,03×22,4 = 0,672 л. (Молярный объём(Vm) - постоянная константа, которую нужно знать).
Элементы в высших степенях окисления проявляют только окислительные свойства, и наоборот, в низшей - только восстановительные свойства. В промежуточных степенях окисления могут быть как окислителями, так и восстановителями.
Таким образом только окислительные свойства проявляют: KMnO4, P2O5, HNO3, H2SO4
Только восстановительные свойства: Na2S
ОВ двойственность: MnO2, SO2, NH3 (аммиак проявляет окислительные свойства за счет ионов водорода 2NH3 + 2Na = 2NH2Na + H2; а восстановительные свойства за счет иона азота 4NH3 + 3O2 = 2N2 + 6H2O).
Объяснение:
m(Zn)=6,5г.
V(O₂)=1,12л.
Объяснение:
n₁(ZnO)=0,1 моль
Vm=22,4л./моль
m(Zn)-? V(O₂)-?
Рішення:
1.
Запишемо рівняння реакції:
2Zn+O₂=2ZnO
а) за рівнянням реакції кількість речовини:
n(Zn)=2моль n(O₂)=1моль n(ZnO)=2моль
б) за умовою задачі кількість речовини:
n₁(ZnO)=0,1моль n₁(Zn)=0,1моль n₁(O₂)=0,05моль
2.
Визначимо молярну масу цинку:
M(Zn)=65=65г./моль
3.
Визначимо масу цинку кількістю речовини 0,1 моль:
m(Zn)=n₁(Zn)×M(Zn)=0,1моль×65г./моль=6,5г.
4.
Визначимо об'єм кисню кількістю речовини 0,05 моль:
V(O₂)=n₁(O₂)×Vm=0,05моль×22,4л./моль=1,12л.
5.
Відповідь: масу цинку 6,5г. , об'єм кисню 1,12л.
между нами тает лёд теперь нас никто не найдет мы мы промок ним подождём а теперь мы только вдвоём курточка моя как из ж*** оно Я обниму тебя чтобы стало хуже всех навонял я на тебя тебе неприятно но мне наплевать всё равно мне приятно вот гавном воняет от тебя и от меня видимо мы мы созданы для друг друга конец а кто слушал тот капец тупой