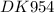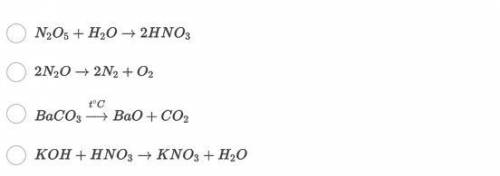
1)CuSO4 + 2HCL= CuCL2 + H2SO4
Такая реакция невозможна,поскольку условием для прохождения реакции обмена должен образоватья газ или слабый электролит или осадок. В данном примере ничего нет.
2)Mg + H₂SO₄ = MgSO₄ + H₂
Mg + 2H⁺ + SO₄²⁻ = Mg²⁺ + SO₄²⁻ + H₂ (ионное полное)
Mg + 2H⁺ = Mg²⁺ + H₂ (ионное сокращенное)
3)Сu ( OH) 2 +2 HCl = CuCL2 +2 H2O
Cu( OH) 2 + 2H = Cu + 2H2O
4)2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na (+) + 2OH(-) + 2H(+) +SO4(2-) = 2Na(+) + SO4(2-) + 2H2O
2OH(-) + 2H(+) = 2H2O или сократив коэффициенты OH(-) + H(+) = H2O
5)AI(OH)3+H2SO4=AI2(SO4)3+H2O
2Al(OH)3 + 6H(+) + 3SO4(2-) = 2Al(3+) + 3SO4(2-) + 6Н2O - полный ионный вид (в скобках указаны заряды ионов, которые записывают справа вверху)
2Al(OH)3 + 6H(+) = 2Al(3+) + 6Н2O - сокращённый ионный вид.
2) 2N₂O → 2N₂ + O₂
Объяснение:
1) N₂⁺⁵O₅⁻² + H₂⁺¹O⁻² → 2H⁺¹N⁺⁵O₃⁻² - Не является Окислительно-восстановительной реакцией, так как степень окисления не изменилось.
2) 2N₂⁺¹O⁻² → 2N₂⁰ + O₂⁰ - Является Окислительно-восстановительной реакцией, так как степень окисления изменилось у азота и кислорода.
3) Ba⁺²C⁺⁴O₃⁻² (t°C) → Ba⁺²O⁻² + C⁺⁴O₂⁻² - Не является Окислительно-восстановительной реакцией, так как степень окисления не изменилось.
4) K⁺¹O⁻²H⁺¹ + H⁺¹N⁺⁵O₃⁻² → K⁺¹N⁺⁵O₃⁻² + H₂⁺¹O⁻² - Не является Окислительно-восстановительной реакцией, так как степень окисления не изменилось.
Решено от :