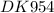BaC2O4
Оксалат бария — соль бария и щавелевой кислоты. Представляет собой белый порошок без запаха. Плохо растворим в воде, растворим в соляной, азотной и уксусной (при нагревании) кислотах. При нагревании до 180°C теряет кристаллизационную воду. При прокаливании разлагается с образованием карбоната бария.
Иногда используется как зеленый краситель в пиротехнических изделиях.
При попадании на кожу вызывает раздражение, при попадании внутрь вызывает тошноту, рвоту и почечную недостаточность.
Молярная масса 225.34 г/моль
Температура разложения 400°С
δt = 1 ч = 3600 с
i = 0,268 a
v(h2) = 11,2 мл = 11,2*10^(-3) л
f = 965480 кл/моль
сульфат кадмия cdso4 – соль, образованная слабым основанием cd(oh)2 и сильной кислотой h2so4 которая в водном растворе гидролизуется по катиону.
2cdso4 + 2н2о = (cdoh)2so4 + h2so4
cd (2+) + н2о = cdoh(+) + н (+) (ph < 7 – среда кислая)
анодный процесс
при электролизе растворов солей, содержащих в своем составе сульфат-ион so4(2-) на аноде происходит окисление воды с выделением свободного кислорода.
анод (+) 2н2о – 4е = 4н (+) + о2↑ (рн < 7)
катодный процесс.
поскольку кадмий в ряду напряжений стоит после алюминия и до водорода, то на катоде одновременно будут протекать два процесса – восстановление ионов cd(2+) и восстановление ионов водорода н (+) (поскольку среда кислая)
cd(2+) + 2e = cd↓
2h(+) + 2e = h2↑
суммарная реакция на катоде
катод cd(2+) + 2h(+) + 4e = cd + h2↑
тогда процессы окисления – восстановления, протекающие при электролизе раствора сульфата кадмия cdso4
2н2о – 4е = 4н (+) + о2↑ | 1 - окисление
cd(2+) + 2h(+) + 4e = cd + h2↑ | 1 – восстановление
суммарно
cd(2+) + 2h(+) + 2н2о = cd + h2↑ + 4н (+) + о2↑
после подобных
cd(2+) + 2н2о = cd + h2↑ + 2н (+) + о2↑
уравнение реакции в молекулярном виде
cdso4 + 2н2о = cd + h2↑ + н2so4 + о2↑
поскольку на катоде одновременно протекают два процесса – восстановление ионов cd(2+) и восстановление ионов водорода h(+), то суммарное количество электричества, затраченное на восстановление ионов кадмия и водорода, будет равно количеству электричества, прошедшего через электролит.
чтобы найти выход по току для кадмия найдем выход по току для водорода.
эквивалентный объем водорода найдем как эквивалентный объем двухатомного газа при н. у.
vэкв (н2) = vm/(2*z(н2)) = 22,4/(2*1) = 11,2 л
vm = 22,4 л/моль – молярный объем при н. у.
z(н2) = 1 – число связей в молекуле н2
по первому закону фарадея найдем количество электричества, затраченное на восстановление водорода объемом 11,2 мл.
v(h2) = vэкв (н2)*q(h2)/f
q(h2) = v(h2)*f/vэкв (н2) = 11,2*10^(-3)*96480/11,2 = 96,48 кл
суммарное количество электричества, прошедшее через электролит.
q = i*δt = 0,268*3600 = 964,8 кл
количество электричества, затраченное на восстановление ионов кадмия.
q(cd) = q – q(h2) = 964,8 – 96,48 = 868,32 кл
выход по току для кадмия
η(cd) = [q(cd)/q]*100% = [868,32/964,8]*100% = 90%
Дано:
m(C₇H₁₆) = 14 гр
V(O₂) = 60 л
Найти:
V(CO₂) - ?
1) Для начала мы запишем уравнение реакций про горение гептана, именно по такой уравнений реакций мы будем пользоваться:
C₇H₁₆ + 11O₂ → 7CO₂ + 8H₂O
2) Далее мы находим количества веществ у гептана и кислорода, а потом определим, какой из них в избытке и в недостатке, а потом находим количества вещества углекислого газа по уравнению реакций:
M(C₇H₁₆) = 12×7 + 1×16 = 84 + 16 = 100 гр/моль
Vm = 22,4 л/моль
n(C₇H₁₆) = m(C₇H₁₆)/M(C₇H₁₆) = 14 гр / 100 гр/моль = 0,14 моль - в недостатке
n(CO₂) = V(CO₂)/Vm = 60 л / 22,4 л/моль ≈ 2,68 моль - в избытке
Следовательно:
n(CO₂) = 7n(C₇H₁₆) = 7×0,14 моль = 0,98 моль - по уравнению реакций
3) Теперь находим объем углекислого газа:
V(CO₂) = n(CO₂)×Vm = 0,98 моль × 22,4 л/моль = 21,952 л ≈ 21,95 л
ответ: V(CO₂) = 21,95 л
Решено от :