В одну стадию нельзя получить этиленгликоль из этанола, поэтому в каждом несколько реакций.
1. Получение по цепочке этанол ⇒ хлорэтан ⇒ винилхлорид ⇒ 1,2-дихлорэтан ⇒ этиленгликоль.
1. Реакция взаимодействия этанола с хлороводородом:
ᅠᅠ
2. Реакция дегидрирования хлорэтана при нагревании и в присутствии Никеля:
ᅠᅠ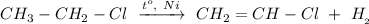
3. Реакция присоединения хлороводорода против правила Марковникова в присутствии пероксида водорода:
ᅠᅠ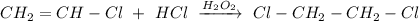
4. Щелочной гидролиз 1,2-дихлорэтана при нагревании водным раствором щёлочи, получаем этиленгликоль:
ᅠᅠ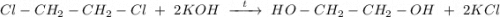
2. Получение по цепочке этанол ⇒ этен ⇒ эпоксид этилена ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ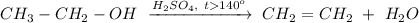
2. Реакция окисления этилена кислородом воздуха в присутствии ионов серебра:
ᅠᅠ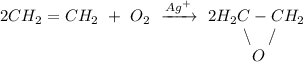
3. Гидролиз эпоксида в кислой среде при нагревании, получение этиленгликоля:
ᅠᅠ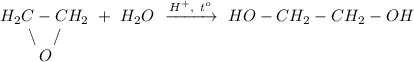
3. Получение по цепочке этанол ⇒ этилен ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ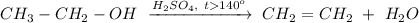
2. Реакция окисления этилена перманганатом калия в нейтральной среде при температуре в 0 градусов:
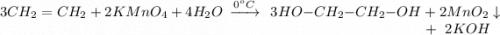
Объяснение:
растворов (решение задач)
Цель занятия: Формирование базовых знаний о определения свойств и концентраций растворов и навыков проведения расчетов.
Требования к знаниям, которые студент должен приобрести в результате освоения темы:
знать выражения состава растворов;
уметь: вычислять состав и количества индивидуальных веществ в растворах
Теоретическая часть:
Растворами называют термодинамически устойчивые гомогенные смеси переменного состава, образованные из двух и более компонентов. Гомогенная система, образующая раствор, может быть твердой или жидкой. В состав каждого раствора обязательно входят растворенные вещества и растворитель. Растворителем называют компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор, либо компонент, концентрация которого выше концентрации других компонентов. Растворитель представляет собой среду, в которой равномерно распределены растворенные вещества и сохраняет свое фазовое состояние при образовании растворов. Компонент раствора, присутствующий в нем в меньшей концентрации, чем растворитель и молекулы которого равномерно распределены между молекулами растворителя, обычно определяют как растворенное вещество.
Состав раствора, в частности, содержание растворенного вещества, может выражаться различными Концентрацией раствора называют содержание растворенного вещества в определенном массовом или объемном количестве раствора или растворителя. В химической практике наиболее часто используются следующие величины, выражающие содержание растворенного вещества в растворе:
Ø Массовая доля растворенного вещества (ω). Массовая доля представляет собой отношение массы растворенного вещества к массе всего раствора. Это безразмерная величина, выражаемая в долях от единицы или в процентах.
ω = или ω =
где mв-ва – масса растворенного вещества, г;
mp – масса раствора, г.
Масса раствора представляет собой сумму масс растворенного вещества и растворителя:
mp = m + mр-ля
Ø Мольная доля (N) – отношение количества растворенного вещества (или растворителя) к сумме всех веществ, составляющих раствор. Также как и массовая доля, мольная доля является безразмерной величиной.
Nв-ва =
Nр-ля =
где νв-ва – количество растворенного вещества, моль;
νp – количество вещества растворителя, моль.
Ø Молярная концентрация растворенного веществаили молярность (СМ). Молярная концентрация вещества в растворе показывает, какое количество растворенного вещества (моль) содержится в 1 литре раствора. Молярная концентрация измеряется в моль/л или моль/дм3 (М).
СМ = или СМ =
где νв-ва – количество растворенного вещества, моль;
mв-ва – масса растворенного вещества, г;
Мв-ва – молярная масса растворенного вещества, г/моль;
Vp-ра – объем раствора, л.
Ø Молярная концентрация эквивалента вещества или нормальность (Сн) – число эквивалентных масс растворенного вещества, содержащегося в 1 литре раствора; единицы измерения – моль эквивалентов/литр (н).
Сн =
где mв-ва – масса растворенного вещества, г;
МЭ – молярная масса эквивалента вещества, г/моль.
Vp-ра – объем раствора, л;
Ø Моляльная концентрация растворенного веществаили моляльность (Сm) – величина, показывающая, какое количества растворенного вещества содержится в 1000 г растворителя. Единицы измерения моляльности – моль/кг или моль/г.