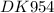Объяснение:
1) Олово — легкий цветной металл, простое неорганическое вещество. В переводе с латинского это значит «прочный, стойкий». Первоначально этим словом называли сплав свинца и серебра, и только значительно позже так стали именовать чистое олово.
2) Эффект инертной 6s^2 пары электронов. Поэтому же у элементов 6 группы устойчивы степени окисления (номер группы минус два)
3) Все три элемента образуют оксиды ЭО и диоксиды ЭО2.
GeО — оксид германия(II);
SnО — оксид олова(II);
PbО — оксид свинца(II);
GeО2 — оксид германия(IV);
SnО2 — оксид олова(IV);
PbО2 — оксид свинца(IV).
Основные свойства гидроксидов увеличиваются, а кислотные уменьшаются в ряду Gе(ОН)2 — Рb(OH)2 — все они являются амфотерными гидроксидами. Gе(ОН)2 больше кислота, чем основание, а у Sn(OH)2 и Рb(OH)2, наоборот, преобладают основные свойства.
Подобная закономерность обусловлена увеличением в группе радиусов ионов при постоянном их заряде за счёт прибавления электронных слоев следует увеличение радиуса атома и иона. Gе(ОН)2 - амфотерный гидроксид с преобладанием кислотных свойств, Sn(OH)2 и Рb(OH)2 - слабые амфотерные основания.
Это можно объяснить с использованием схем Косселя. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи
Э — Н и Э — О — Н, в зависимости от заряда ядра и радиуса образующего их элемента. Рассмотрим схему Косселя для Ge(ОН)2, Sn(ОН)2 и Pb(ОН)2:
Объяснение:
1) Олово — легкий цветной металл, простое неорганическое вещество. В переводе с латинского это значит «прочный, стойкий». Первоначально этим словом называли сплав свинца и серебра, и только значительно позже так стали именовать чистое олово.
2) Эффект инертной 6s^2 пары электронов. Поэтому же у элементов 6 группы устойчивы степени окисления (номер группы минус два)
3) Все три элемента образуют оксиды ЭО и диоксиды ЭО2.
GeО — оксид германия(II);
SnО — оксид олова(II);
PbО — оксид свинца(II);
GeО2 — оксид германия(IV);
SnО2 — оксид олова(IV);
PbО2 — оксид свинца(IV).
Основные свойства гидроксидов увеличиваются, а кислотные уменьшаются в ряду Gе(ОН)2 — Рb(OH)2 — все они являются амфотерными гидроксидами. Gе(ОН)2 больше кислота, чем основание, а у Sn(OH)2 и Рb(OH)2, наоборот, преобладают основные свойства.
Подобная закономерность обусловлена увеличением в группе радиусов ионов при постоянном их заряде за счёт прибавления электронных слоев следует увеличение радиуса атома и иона. Gе(ОН)2 - амфотерный гидроксид с преобладанием кислотных свойств, Sn(OH)2 и Рb(OH)2 - слабые амфотерные основания.
Это можно объяснить с использованием схем Косселя. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи
Э — Н и Э — О — Н, в зависимости от заряда ядра и радиуса образующего их элемента. Рассмотрим схему Косселя для Ge(ОН)2, Sn(ОН)2 и Pb(ОН)2:
Дано:
V(р-ра HCl) = 350 мл
ρ(р-ра HCl) = 1,05 гр/мл
V(газа) = 11,2 л
Найти:
ω(HCl) - ?
1) Для начала мы запишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться:
FeS₂ + 2HCl → FeCl₂ + H₂S↑
2) Для начала мы находим количества у выделившегося в результате газ, потом находим количества у соляной кислоты из уравнения реакций:
Vm = 22,4 л/моль
n(H₂S) = V(газа)/Vm = 11,2 л / 22,4 л/моль = 0,5 моль ⇒ n(HCl) = 2n(H₂S) = 2×0,5 моль = 1 моль - по уравнению реакций
3) Далее находим массу у соляной кислоты:
M(HCl) = 1 + 35,5 = 36,5 гр/моль
m(HCl) = n(HCl)×M(HCl) = 1 моль × 36,5 гр/моль = 36,5 гр
4) Далее находим массу раствора у соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) × ρ(р-ра HCl) = 350 мл × 1,05 гр/мл = 367,5 гр
5) Теперь находим массовую долю у соляной кислоты:
ω(HCl) = m(HCl)/m(р-ра HCl) × 100% = 36,5 гр / 367,5 гр × 100% ≈ 0,0993 × 100% ≈ 9,93%
ответ: ω(HCl) = 9,93%
Решено от :