Zn(NO3)2 = ZnO+2NO2+O2-210кДж/моль
На разложение 1 моля Zn(NO3)2 расходуется 210кДж теплоты, соответственно, поскольку израсходовано только 63кДж теплоты, значит было 63*1/210 = 0.3 моль.
M[Zn(NO3)2] = 189г/моль
M(ZnO) = 81г/моль
n(ZnO) = n[Zn(NO3)2] = 0.3моль
m(NaOH) = 375.7*0.064= 24.045 г
n(NaOH) = m/M = 24,045/40 = 0.6моль
m(H2O) = 375.7 - 24.045 = 351.655 г
ZnO + 2NaOH + Н2О = Na2[Zn(OH)4]
M[Na2[Zn(OH)4] = 179 г/моль
m[Na2[Zn(OH)4] = n*M = 0.3*179 = 53.7 г
Находим массовую долю:
w(соли) = m(соли)/m(раствора)*100% = 53.7/[53.7 + 351.655 - (0.3*18)] *100% = 13.07%
ответ: 13.07%.

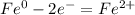
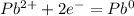
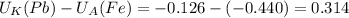 В (Вольт)
В (Вольт) то ЭДС необходимо рассчитать с формулы Нернста:
то ЭДС необходимо рассчитать с формулы Нернста:![((U_{K})^o+ \frac{0,059}{n}lg[Me^{n+}]_k)-( (U_{A})^o)+ \frac{0,059}{n}lg[Me^{n+}]_a )](/tpl/images/0408/4708/bd0bf.png)
 В (Вольт)
В (Вольт)
Состояние химического равновесия это когда скорость прямой и обратной ей реакции равны.
Объяснение: