Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот
ряд можно представить с следующих превращений:
Металл → основный оксид → щёлочь → соль
Например, K → K2O → KOH → KCl
2. Генетический ряд, где в качестве основания выступает нерастворимое
основание, тогда ряд можно представить цепочкой превращений:
Металл → основный оксид → соль → нерастворимое основание →
оксид → металл
Например, Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
Среди неметаллов также можно выделить две разновидности
рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает
растворимая кислота. Цепочку превращений можно представить в
следующем виде:
Неметалл → кислотный оксид → растворимая кислота → соль
Объяснение:
Метод электронного баланса можно разделить на несколько этапов:
1) Найти окислитель и восстановитель.
2) Составить полуреакции перехода электронов
3) Уравнять число принятых и отданных электронов в данной полуреакции
4) Просуммировать левые и правые части полуреакций.
5) Расставить недостающие коэффициенты у элементов,которые не меняли степень окисления (СО)
Например:
1 Этап:
Азот в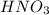 из СО +5 перешел в СО +2 в
из СО +5 перешел в СО +2 в 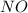 , он принял электроны => является окислителем.
, он принял электроны => является окислителем.
Медь в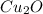 из СО +1 перешла в СО +2 в
из СО +1 перешла в СО +2 в 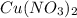 , она отдала электроны => является восстановителем.
, она отдала электроны => является восстановителем.
2 Этап:
( !Нужно учитывать, что в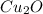 2 атома меди, поэтому было отдано 2 электрона)
2 атома меди, поэтому было отдано 2 электрона)
3 Этап:
Число принятых и отданных электронов должно быть одинаково, поэтому надо домножить каждую из полуреакций на такое число, чтобы их было поровну, в данном случае по 6 электронов
4 Этап:
Сокращаем электроны:
5 Этап:
В левой части меньше азота, чем в правой, поэтому увеличиваем коэффициент перед азотной кислотой на 12 (столько не хватает азота)
Теперь в левой части больше кислорода чем в правой, поэтому увеличиваем коэффициент перед водой на 7 (столько не хватает кислорода)
Проверяем кол-во водорода в правой и левой части. И там, и там их поровну (14) => коэффициенты расставлены