1. Что отибочно для переходных элементов? в) большинство проявляют переменную степень окислення. A) nce металлы
С) атом Fе имеет конфигура no ...35'3p/3d 4s
D) атом Ст вмест конфигурацию...3s23p 3d34.! E) атом Си имеет конфигурацию...3 - 3p 3d4s2
2. Какая схема, составленная для железа, ошибочна? B) Fe + CuSO, → FeSO + Cu
A) Fe + O₂ ropenire
C) Fe + HNO3(KOHM.) 20 с. - пассивируется
20° с
E) Fe + H₂SO4(KOHU.)
D) Fe+ H₂O(nap) FeiOs+ H₂T
→→→Fe (SO₂), +SO₂T+H₂O
3. Какое выражение ошибочно для пона Fer?
А) можно определить роданилом калия С) гидроксил его не реагирует с щелочью E) растворимые соли подвергаются гидролизу
4. Перепишите схемы в тетрадь и завершите их.
1. Fe + H₂O +0₂ →
4. Zn + H2O(пары)
2. Fe + H₂O(nap)
5. Zn NaOH,
5. Укажите верные выражения.
B) можно определить щелочью D) гидроксид сго-бурый осадок
3. Fe + H₂SO4(KOHIL) 6. Zn+NaOH+H₂O2C>
1. в доменной печи протекают реакции окисления и восстановления 2. в доменной печи протекают реакции замещения, разложения и соединения
3. вдувание природного газа вместе с воздухом не влияет на доменный процесс
4. в домне шлак предохраняет чутун от окисления 5. в составе литейного чугуна углерод находится в основном, в виде цементита 6. Перепишите схемы в тетрадь и завершите их.
1. Cr +
4. Fe2O3
H₂SO4(pa36.) +CO
-CO₂
→ +CO
- CO₂
7. Укажите верные выражения.
1. медь - тугоплавкий металл
2. Cr+ HCI→→ +CO
-CO₂
2. при 20°С медь на сухом воздухе не окисляется
3. медь реагирует с азотной и концентрированной серной кислотами 4. при 20°С хром пассивируется концентрированной азотной кислотой 5. соединения двухвалентного хрома - сильные восстановители
6. Crоз - сильный окислитель
8. Укажите соответственно соли метахромистой, хромовой и дихромовой кислот.
1. Na2Cr2O7
2. NaCrO2
9. С какими веществами цинк вступает в реакцию?
1. H2O
2. HCI
3. KOH
4. 0₂
3. Na₂CRO4
5. MgSO4
10. При полном восстановлении 9 г смеси, состоящей из железа и оксида железа(II
было получено 7,4 г железа. Вычислите массовую долю (%) железа в исходнс
смеси. А.(Fe)=56, A.(O)=16.
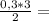 0,45 моль
0,45 моль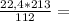 42,6г
42,6г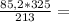 130г
130г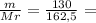 0,8 моль
0,8 моль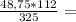 16,8г
16,8г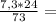 2,4г
2,4г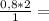 1,6 моль
1,6 моль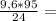 38г
38г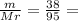 0,4моль
0,4моль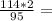 2,4г
2,4г
Вещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
Примеры: КОН, СаСО, СНСООК, NHNO, [CHNH]Cl, СНОК.
Свойства ионных кристаллов:
твердые, но хрупкие;
отличаются высокими температурами плавления;
нелетучи, не имеют запаха;
расплавы ионных кристаллов обладают электропроводностью;
многие растворимы в воде; при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Металлическая решетка
Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и обусловлены свойства веществ с металлической решеткой:
тепло- и электропроводность;
обладают металлическим блеском;
высокие температуры плавления.
Атомная решетка
В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит), бора, кремния, германия, оксида кремния SiO (кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN.
Свойства веществ с атомной решеткой:
высокая твердость;
высокие температуры плавления;
нерастворимость;
нелетучесть;
отсутствие запаха.
Молекулярная решетка
В узлах — молекулы веществ, которые удерживаются в решетке с слабых межмолекулярных сил.
Молекулярное строение имеют:
все органические вещества (кроме солей);
вещества — газы и жидкости;
легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Объяснение: