Se (селен)
1S2; 2S2; 2p6; 3p6; 3d10; 4S2; 4p4.
Высший оксид SeO3
Гидроксид H2SeO4
Семейство серы, р-элементы. Находится в четвертом периоде, VI группы главной А подгруппы.
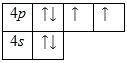
Внешний энергетический уровень атома селена содержит 6 электронов, которые являются валентными. (фото 1)
Наличие двух неспаренных электронов свидетельствует о том, что степень окисления селена равна +2. Так как на четвертом уровне есть вакантные орбитли 4d - подуровня, то для атома селена характерное наличие возбужденного состояния.(фото 2)
Окисление - это процесс отдачи электронов.
Mn{2+} - 5e- = Mn{7+}
Восстановление - процесс присоединения электронов.
S{6+} + 8e- = S{2-}
Типы ОВР:
Межмолекулярные - окислительные функции выполняют одни вещества, а восстановительные - другие:
H2S+Cl2=S+2HCl
Внутримолекулярные - одна часть молекулы окислитель, вторая - восстановитель:
(NH4)2Cr2O7=N2+Cr2O3+4H2O
Диспропорционирование - одновременное окисление и восстановление атомов одного элемента:
Br2+H2O=HBr+HBrO
Конпропорционирование - атомы одного элемента в разных степенях окисления переходят к общей степени окисления:
2H2S+SO2=2H2O+3S
NH4NO2=N2+2H2O
Відповідь:
калия иодид KI+AgNO3=AgI+KNO3-(выпадает осадок желтого цветаAgI)
калия сульфат K2SO4+Ba(NO3)2=BaSO4+2KNO3-выпадает белый осадок BaSO4 (реакция на сульфаты -соль бария)
калия хлорид KCI+AgNO3 =AgCI+KNO3 выпадает белый творожистый осадок AgCI (реакция на хлориды- нитрат серебра)
калия бромид KBr+AgNO3=AgBr+KNO3-(выпадает осадок светло-желтого цвета AgBr)
AgNO3 -реактив на все галогены
Пояснення: