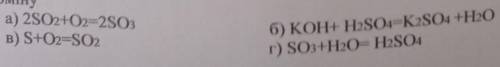
Можешь мой ответ посчитать лучшим!
Объяснение:
Сірка (S)
Атомний номер 16
Зовнішній вигляд простої речовини світло-жовта, в чистому
вигляді без запаху
Властивості атома
Атомна маса (молярна маса) 32,066 а.о.м. (г/моль)
Радіус атома 127 пм
Енергія іонізації (перший електрон) 999,0(10,35) кДж/моль (еВ)
Електронна конфігурація [Ne] 3s2 3p4
Хімічні властивості
Ковалентний радіус 102 пм
Радіус іона 30 (+6e) 184 (-2e) пм
Електронегативність (за Полінгом) 2,58
Електродний потенціал 0
Ступені окиснення 6, 4, 2, -2
Термодинамічні властивості
Густина 2,070 г/см³
Молярна теплоємність 0,732 Дж/(К·моль)
Теплопровідність 0,27 Вт/(м·К)
Температура плавлення 388.36 К
Теплота плавлення 1,23 кДж/моль
Температура кипіння 717,824 К
Теплота випаровування 10,5 кДж/моль
Молярний об'єм 15,5 см³/моль
Кристалічна ґратка
Структура ґратки орторомбічна
Період ґратки 10,470 Å
Відношення с/а n/a
Температура Дебая n/a К
Сі́рка, су́льфур ( — хімічний елемент з атомним номером 16, що належить до 16-ї групи, 3-го періоду періодичної системи хімічних елементів.
Проста речовина — сі́рка, неметал, жовта кристалічна речовина. Трапляється в природі в самородному стані та у вигляді сульфідів важких металів, піриту та інших. Сірку застосовують переважно у хімічній промисловості для виробництва сірчаної кислоти, синтетичного волокна, сірчистих барвників, димного пороху, у гумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
Завдяки здатності створювати дисульфідні зв'язки, сірка виконує важливу роль у складі білків. Ртуть порушує ці зв'язки, тому вона є токсичною.
типы кристаллических решеток:
1) Ионная кристаллическая решетка.
Характер связи между частицами: Электростатические силы притяжения и ионные связи.
Примеры: соли, щелочи (KOH,NaOH),оксиды типичных металлов.
2) Атомная кристаллическая решетка.
Характер связи: ковалентная.
Примеры: Алмаз, оксиды Al; Si.
3) Молекулярная кристаллическая решетка.
Характер связи: ковалентная полярная, ковалентная неполярная.
Примеры: Большинство органических веществ.
4) Металлическая кристаллическая решетка.
Характер связи: Металлическая, межмолекулярные притяжения.
Примеры: Все металлы и сплавы. (Mg, Ba, Li, Ca)
2. Соли.
Соли (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы металла (или аммония NН4+) и анионы кислотного остатка.
Классификация:
1. Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
2.Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты.
3.Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: .
4. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
5. Смешанные соли — в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды.
6.Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Примеры:
NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция
3 номер:
4P + 5O₂ = 2P₂O₅
M(O₂) = 16 * 2 = 32 г/моль
М(P₂O₅) = 31 * 2 + 16 * 5 = 142 г/моль
m(O₂) = (71 г * 32 г/моль * 5 моль) : (142 г/моль * 2 моль) = 40 г
ответ: 40г.
Удачи:)