1. При комнатной температуре кислород реагирует со всеми металлами.
Неверно
2. Кислород окисляет щелочноземельные металлы при обычных условиях.
Верно
3. В лаборатории кислород можно получить из вещества, формула которого:
KMnO4
4. В результате разложения воды не образуется(-ются):
H2O
K2O2
5. Для химического элемента или простого вещества кислорода неверно утверждение:
В реакциях с неметаллами проявляет восстановительные свойства.
6. Кислород отличается от озона:
Физическими свойствам и.
7. Выбери характеристику озона:
Образуется в воздухе во время грозы .
8. Только при нагревании кислород реагирует с:
Mg - С магнием.
 -реакция разложения(из одного вещества образуется два продукта),эндотермическая(требуется нагревание,т.е. энергия из вне)
-реакция разложения(из одного вещества образуется два продукта),эндотермическая(требуется нагревание,т.е. энергия из вне)
720 000 г х л

32 г 22,4 л
1. Так как техническая сера содержит 10% примесей,значит массовая доля ее в образце - 90%:
800 кг - 100%, а
у кг____90, откуда х=800*90/100=720 кг
2. Переведя кг в граммы и подставив массу в уравнение реакции,получим:
при взаимодействии 32 г серы образуется 22,4 л оксида,а
при -- // -- 720000 г____________х л, откуда х=720000*22,4/32=504000 л или 504 м в кубе

0 0 +3 -1

0 +3
Cr - 3e = Cr |2|восстановитель(окисление)
0 -1
Cl_2 + 2e = 2Cl |3|окислитель(восстановление)
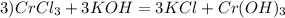
m (H2S) = 5.1 г
n , N (H2S) = ?
Решение:
n = m / M , N = Na x n
M (H2S) = 2 + 32 = 34 г/моль
n = 5.1 / 34 г/моль = 0.15 моль
N = 6 x 10 в 23 степени x 0.15 = 0.9 x 10 в 23 степени
2) а) Дано:
n (H) = 1.5
N = ?
Решение:
N = Na x n
N = 6 x 10 в 23 степени x 1.5 = 9 x 10 в 23 степени
2) б) Дано:
m (H) = 7 г
N (H) = ?
Решение:
N = Na x n , n = m /M
M (H) = 1 г/моль
n = 7 г / 1 г/моль = 7 моль
N = 6 x 10 в 23 степени x 7 моль = 42 x 10 в 23 степени