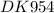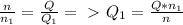
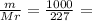 4,4 моль
4,4 моль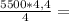 6,050 кДЖ
6,050 кДЖ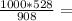 581,5г
581,5г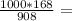 185г
185г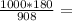 198,25г
198,25г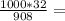 35,25г
35,25г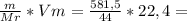 296л
296л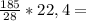 148л
148л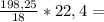 246,7л
246,7л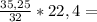 24,675л
24,675лВсе указанные вещества можно распознать при свежеосажденного гидроксида меди - Cu(OH)2;
CH2(OH)-CH(OH)-CH2(OH) + Cu(OH)2 => ярко-синий раствор, не меняющий цвет при нагревании;
СН3СОН + 2Сu(OH)2 = CH3COOH + Cu2O + 2H2O (сначала образуется желтый осадок, при нагревании становится оранжевым);
2СH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O (осадок Cu(OH)2) - осадок Cu(OH)2 растворяется, образуется прозрачный раствор);
Глюкоза + Cu(OH)2= сначала образуется ярко-синий раствор, при нагревании превращается в оранжевый осадок)
Подробнее - на -
Объяснение:
Дано:
m(р-ра Ca₃(PO₄)₂) = 7,5 кг
ω(примесей) = 7%
Найти:
m(P₄) - ?
1) Для начала мы запишем уравнение реакций из условия задачи:
2Ca₃(PO₄)₂ + 6SiO₂ + 10C → 10CO↑ + P₄ + 6CaSiO₃
2) Далее мы находим массовую доля у фосфата кальция, а потом находим массу чистого вещества у фосфата кальция:
ω(Ca₃(PO₄)₂) = 100% - ω(примесей) = 100% - 7% = 93%+
m(Ca₃(PO₄)₂) = (m(р-ра Ca₃(PO₄)₂) × ω(Ca₃(PO₄)₂)) / 100% = (7,5 кг × 93%) / 100% = 7,5 кг × 0,93 = 6,975 кг
3) Теперь находим количества вещества у фосфата кальция, а потом у фосфора при уравнения реакций:
M(Ca₃(PO₄)₂) = 40×3 + (31 + 16×4)×2 = 120 + (31 + 64)×2 = 120 + 95×2 = 120 + 190 = 310 кг/кмоль
n(Ca₃(PO₄)₂) = m(Ca₃(PO₄)₂)/M(Ca₃(PO₄)₂) = 6,975 кг / 310 кг/кмоль = 0,0225 кмоль
n(Ca₃(PO₄)₂) : n(P₄) = 2 : 1 , следовательно:
n(P₄) = n(Ca₃(PO₄)₂)/2 = 0,0225 кмоль / 2 = 0,01125 кмоль
4) Теперь находим массу фосфора:
M(P₄) = 31×4 = 124 кг/кмоль
m(P₄) = n(P₄) × M(P₄) = 0,01125 кмоль × 124 кг/кмоль = 1,395 кг ≈ 1,4 кг
ответ: m(P₄) = 1,4 кг
Решено от :