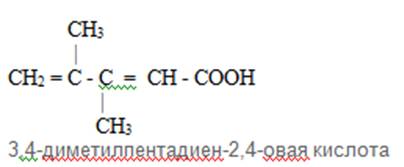
1. Галогены характеризуются следующим свойством: б) при взаимодействии с металлами образуют соли;
2. Металл, который можно использовать для получения водорода (путем взаимодействия его с водой при н. у.): д) К;
3. Оксиды и гидроксиды, которые реагировать и кислотами, и со щелочами, называют: а) амфотерными
4. Слева направо в периодах металлические свойства: б) ослабляются
5. Элемент побочной подгруппы VII группы: в) марганец
6. Заряд ядра атома определяется: в) по порядковому номеру
7. Одинаковое в строении атомов элементов с порядковыми номерами 17 и 35:г) число электронов на последнем энергетическом уровне;
8. Элемент с электронной формулой 1s22s2р63s2p4: б) сера;
9. Атом углерода имеет электронную формулу: в) 1s22s22p2
10. Атом какого элемента имеет следующее строение последнего энергетического уровня…3s23p5: в) хлор;
11. Число неспаренных электронов в электронной оболочке элемента № 19: а) 1;
12. Порядковый номер элемента, атомы которого образовывать высший оксид типа RO3: в) № 16 (сера);
13. Элемент с электронной формулой 1s22s22p63s23p5 образует летучее водородное соединение типа: г) HR;
14. Объем 3 моль водорода при нормальных условиях: в) 67,2 л;
15. Элемент четвертого периода, расположен в побочной подгруппе; оксид и гидроксид проявляют амфотерный характер. Этот элемент образует оксид типа RO и гидроксид R(OH)2. в) цинк
16. Максимальная валентность кремния: а) IV б
17. Минимальная валентность селена (№ 34): б) II
18. Молекулярная масса соли, полученной взаимодействием двух высших оксидов элементов с конфигурацией атома в них соответственно 1s22s22p63s23p64s1 и 1s22s22p3 равна: г) 101;
19. Продукт «Х», который получается в результате превращений: Al соль Al(OH)3 Х а) Al Cl3 в) Na Al O2 г) Al д) Al2O3
20. Сумма коэффициентов в уравнении реакции, схема которой H2S + O2 → SO2 + H2O д) 9;
21. Молярная масса оксида магния (в г/моль): в) 40;
22. Количество молей оксида железа (III), составляющих 800 г данного соединения: д) 5; 23. При сгорании 8 г. метана СН4 выделилось 401 кДж теплоты. Вычислите тепловой эффект (Q) химической реакции CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + Q : в) - 802 кДж;
24. При нормальных условиях 128 г кислорода занимают объем: д) 89,6 л;
25. Массовая доля водорода в соединении SiH4 составляет: б) 12,5%;
26. Массовая доля кислорода в соединении ЭО2 равна 50%. Название элемента Э в соединении: в) сера;
; 27. Количество молей оксида железа (III), взаимодействующих с 44,8 л водорода (н.у.): а) 0,67 моль;
28. Масса соляной кислоты, необходимая для получения 44,8 л водорода (н.у.) (Mg + 2HCl = MgCl2 + H2): а) 146 г;
29. Масса соли, которая содержится в 400 г 80%-ного раствора хлорида натрия: б) 320 г; такого раствора не бывает!
30. Масса соли, которая образуется при взаимодействии гидроксида калия с 300 г 65%-ного раствора ортофосфорной кислоты: а) 422 г;