2KMnO4=K2MnO4+MnO2+O2
Mn{7+} + e = Mn{6+}. |1
Mn{7+} + 3e = Mn{4+} |1
2O{2-} - 4e = O2{0}. |1
5FeCl2+3KMnO4+24HCl=5FeCl3+5Cl2
+3MnCl2+3KCl+12H2O
Fe{2+} - e = Fe{3+}. |5
2Cl{-} - 2e = Cl2{0}. |5
Mn{7+} + 5e = Mn{2+} |3
Объяснение:
m(BaSO4) = 46,6 г
Объяснение:
Дано :
m(BaCl2) = 41.6 г
Найти :
m(BaS) - ?
BaCl2+Na2SO4 = BaSO4↓+2NaCl
В данной реакции осадком будет сульфат бария(BaSO4)
1) n(BaCl2) = m/M
M(BaCl2) = 137+35.5*2=208 г/моль
n(BaCl2) = 41,6 г/208 г/моль = 0,2 моль
n(BaCl2) = 0,2 моль
2) так как и у BaCl2 и у BaSO4 коэффиценты одинаковые =>
n(BaSO4) = n(BaCl2) = 0,2 моль
n(BaSO4) = 0,2 моль
3) m(BaSO4) = n*M
M(BaSO4) = 137+32+16*4 = 233 г/моль
m(BaSO4) = 0,2 моль * 233 г/моль = 46,6 г
m(BaSO4) = 46,6 г
ответ : m(BaSO4) = 46,6 г
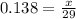
2KMn⁺⁷O₄⁻² = K₂Mn⁺⁶O₄ + Mn⁺⁴O₂ + O₂⁰
Mn⁺⁷ + e⁻ = Mn⁺⁶ | | 1 окислитель, процесс восстановления
Mn⁺⁷ + 3e⁻ = Mn⁺⁴ | 4 | 1 окислитель, процесс восстановления
2O⁻² - 4e⁻ = O₂⁰ | | 1 восстановитель, процесс окисления
5Fe⁺²Cl₂ + 3KMn⁺⁷O₄ + 12HCl⁻ = 5FeCl₃ + 5Cl₂⁰ + 3Mn⁺²Cl₂ + 3KCl + 12H₂O
Fe⁺² - e⁻ = Fe⁺³ | | 5 восстановитель, процесс окисления
2Cl⁻ - 2e⁻ = Cl₂ | 15 | 5 восстановитель, процесс окисления
Mn⁺⁷ + 5e⁻ = Mn⁺² | | 3 окислитель, процесс восстановления