1. При прибавлении к раствору цитрата избытка известковой воды на холоду осадка не образуется. При нагревании же выпадает хлопьевидный осадок цитрата калия, при охлаждении (в закрытой колбе) вновь растворяющийся.
2. Нагревают 5 мл 1%-ного раствора лимонной кислоты с 1 мл реактива Дениже (5 г окиси ртути растворяют в смеси 20 мл концентрированной серной кислоты и 100 мл воды при нагревании до кипения) и прибавляют несколько капель 2%-ного раствора пер-манганата калия. Жидкость обесцвечивается и выпадает белый кристаллический осадок:
Промытый осадок растворяется в растворе хлорида натрия с образованием хлорида ртути и ацетон-дикарбоновой кислоты, которая с хлоридом железа дает малиново-красное окрашивание. 3. Реакция образования пентабромацетона
К водному раствору лимонной кислоты или цитрата в очень разбавленной серной или азотной кислоте (но не соляной) прибавляют
2-5 капель 0,1 н. раствора перманганата калия и нагревают в течение непродолжительного времени до 30-40° (только не кипятить!). Как только раствор побуреет или помутнеет от незначительного выделения двуокиси марганца, прибавляют 1-2 капли раствора ок-салата аммония и 1 мл 10%-ной серной кислоты, при этом жидкость становится прозрачной. Затем прибавляют несколько капель бромной воды. При этом выделяется кристаллический осадок пента-бромацетона.1
4.Глюкоза даёт синее окрашивание с свежеприготовленным Сu(OH)2. Даёт реакцию серебрянного зеркала с Ag(NH3)2OH/
 моль
моль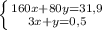
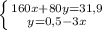

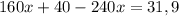

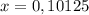 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)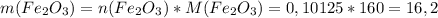 г
г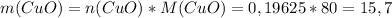 г
г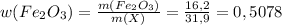 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)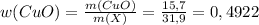 или 49,22%
или 49,22%
NaHSO4+NaOH=Na2SO4+H2O
1) m(NaOH)=144*0,1*1,11=16 г v(NaOH)=16\40=0,4 моль
v(NaOH)=v(NaHSO4)=0,4 моль
m(NaHSO4)=0,4*120=48 г
2) пусть x=m(Na2SO4)
0,6=x\(x+48)
0,6x+28,8=x
x=72
m(NaSO4)=72 г
3) 2NaHSO4+2BaOH=2NaOH+2BaSO4 v(NaHSO4)=v(BaSO4)=0,4моль m1(BaSO4)=233*0,4=93,2 г
4)Na2SO4+BaOH=BaSO4+NaOH
v(Na2SO4)=72\142=0,5моль
v(Na2SO4)=v(BaSO4)=0,5моль
m2(BaSO4)=116,5 г
5) m1(BaSO4)+m2(BaSO4)=116,5+93,2=209,7 г
ответ: m(BaSO4)=209,7 г