Дано:
m(p-pa KOH)= 100 г
ω(KOH) = 30% или 0,3
m(p-pa HNO3) = 100 г
ω(HNO3) = 30% или 0,3
Найти:
m(KNO3)-?
Решение.
m(KOH) = m(p-pa KOH)*ω(KOH) = 100 г*0,3 =30 г
М(КОН) = 56 г/моль
n(KOH) = m/M = 30 г/56 г/моль = 0,5357 моль
m(HNO3) = m(p-pa HNO3)*ω(HNO3) = 100 г*0,3 = 30 г
M(HNO3) = 63 г/моль
n(HNO3) = m/M = 30 г/63 г/моль = 0,47619 моль
M(KNO3) = 101 г/моль
KOH + HNO3 = KNO3 + H2O
Из УХР видно, что n(KOH):n(HNO3) = 1:1, согласно расчетам по данным задачи n(KOH):n(HNO3) = 0.5357:0,47619 = 1.125:1, следовательно, КОН взят в избытке; из УХР видно, что n(KNO3)=n(HNO3) = 0,47619 моль
m(KNO3) = n*M = 0,47619 моль*101 г/моль = 48,1 г
ответ: 48,1 г
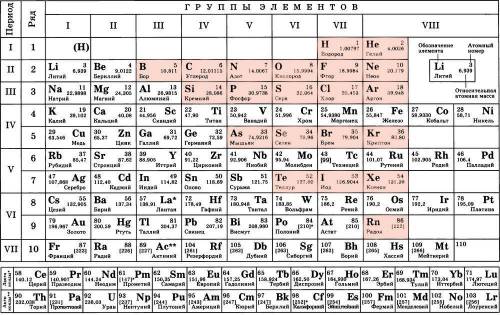
Для начала укажем место расположения атомов-неметаллов в ПСХЭ Д.И. Менделеева.
Начиная с третьей группы главной подгруппы, каждая группа "дарит" нам один элемент-неметалл.
В третей группе главной подгруппы неметалл - бор.
В четвёртой группе главной подгруппы неметаллы - углерод, кремний.
В пятой группе главной подгруппы неметаллы - азот, фосфор, мышьяк.
В шестой группе главной подгруппы неметаллы - кислород, сера, селен, теллур.
В седьмой группе главной подгруппы неметаллы - водород (но иногда его ставят и первую группу главную подгруппу, так как он строением похож на щелочные металлы : также имеет на своём внешнем энергетическом уровне один валентный электрон), фтор, хлор, бром, иод (астат является радиоактивным металлом).
В восьмой группе главной подгруппы неметаллы - это все инертные газы : гелий, неон, аргон, криптон, ксенон, радон.
(Хочу отметить, что есть и другие поиска элементов-неметаллов в ПСХЭ : например, проведение диагонали от нижнего правого края бора до нижнего левого края астата).
Итак, что объединяет выше перечисленные неметаллы?
Если мы вспомним правило : "Количество валентных электронов химического элемента, который находится в главной подгруппе, равно номеру его группы", то мы поймём, что большинство неметаллов имеет больше трёх (за исключением бора и гелия) электронов на своём внешнем энергетическом уровне.
Это также является их отличительной особенностью от элементов-металлов! Потому что большинство элементов-металлов имеют от одного до трёх электронов на своём внешнем слое. То есть, им проще отдать электроны, нежели их присоединить (отсюда металлы и являются восстановителями в химических реакциях).
ν(HF) = m(HF) : M(HF) = 80 г : 20 г/моль = 4 моль.
Если бы диссоциация происходила полностью, то ν(Н⁺) было бы равно 4 моль. Но у нас в растворе находится 0,32 моль. Тогда степень диссоциации равна
α = 0,32 моль / 4 моль = 0,08 = 8%.