Дано:

m р-р(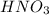 ) = 15 г
) = 15 г
ω(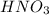 ) = 20%
) = 20%
m(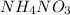 ) — ?
) — ?
Реакция нейтрализации азотной кислоты раствором аммиака —
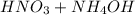 →
→ 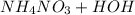 — реакция обмена.
— реакция обмена.
Найдём массу азотной кислоты в растворе:
m(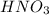 ) = m р-р(
) = m р-р(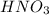 ) * ω(
) * ω(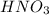 ) = 15 г * 0,2 = 3 г.
) = 15 г * 0,2 = 3 г.
Исходя из полученного результата, выйдем на количество азотной кислоты:
n(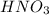 ) = m(
) = m(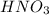 ) / M(
) / M(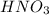 ) = 3 г / 63 г/моль ≈ 0,0476 моль
) = 3 г / 63 г/моль ≈ 0,0476 моль
Так как по уравнению индексы при 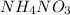 и
и 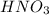 совпадают, то их количество равно:
совпадают, то их количество равно:
n(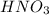 ) = n(
) = n(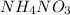 ), следовательно
), следовательно
n(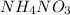 ) = 0,0476 моль.
) = 0,0476 моль.
Тогда масса нитрата аммония равна
m(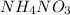 ) = n(
) = n(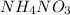 ) * M(
) * M(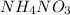 ) = 0,0476 моль * 80 г/моль ≈ 3,8 г
) = 0,0476 моль * 80 г/моль ≈ 3,8 г
ответ: m(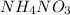 ) = 3,8 г.
) = 3,8 г.
Дано m(FeSO4*хH2O)=55,6 г
m (раств)=121,6 г
w(FeSO4)=25%=0,25
М(FeSO4)=152 г/моль
w(в-ва)=m(раств.в-ва)/m(р-ра), m(в-ва)=w(раств.в-ва)*m(р-ра)
n=m/M , m=n*М
1) Находим массу соли FeSO4 в растворе m(в-ва)=w(раств.в-ва)*m(р-ра)
m(в-ва)= 0,25*121,6=30,4г
2) Находим количество соли FeSO4, n=m/M = 30,4/152=0,2моль
3) В 1 моле FeSO4*хH2O содержится 1 моль FeSO4 , значит
n (FeSO4*хH2O)=n (FeSO4)= 0,2 моль
4) Находим молярную массу кристаллогидрата М(FeSO4*хH2O )=55,6/0,2=278 г/моль
5) Масса воды в кристаллогидрате М(FeSO4*хH2O)- М(FeSO4)=278=152=126 г
6) Находим количество воды n(Н2О)=126/18=7
FeSO4*7H2O
Co - восстановитель
Ag - окислитель