1)
Дано:
m(AgNO₃)=59,5г.
-----------------------
m(BaCI₂)-?m(AgCI)-?
1. Молярная масса нитрата серебра:
M(AgNO₃)=107+14+16x3=169г./моль
2. Количество вещества нитрата серебра в 59,5г.:
n₁(AgNO₃)=m(AgNO₃)÷M(AgNO₃)
n₁(AgNO₃)=59,5г.÷169г./моль=0,35моль
3. BaCI₂+2AgNO₃=2AgCI+Ba(NO)₂
по уравнению реакции:
n(BaCI₂)=1моль n(AgNO₃)=2моль n(AgCI)=2моль
по условию задачи:
n₁(AgNO₃)=0,35моль, значит n₁(BaCI₂)=0,18моль n₁(AgCI)=0,35моль
4. Молярная масса хлорида бария:
M(BaCI₂)= 137+2x35,5=208г./моль
5. Масса хлорида бария количеством вещества 0,18моль :
m(BaCI₂)=n₁(BaCI₂)xM(BaCI₂)
m(BaCI₂)=0,18мольх208г./моль=37,44г.
6. Молярная масса хлорида серебра:
M(AgCI)=107++35,5=142,5г./моль
7. Масса хлорида серебра количеством вещества 0,35моль:
m(AgCI)=n₁(AgCI)xM(AgCI)
m(AgCI)=0,35мольx142,5г./моль=49,9г.
8. ответ: В результате взаимодействия хлорида бария с нитратом серебра массой 59,5г. потребовалось 37,44г. хлорида бария и образовалось 49,9г. хлорид серебра.
2)
Дано:
m(технического NaOH)=100г.
ω%(примесей)=20%
---------------------------------
m(H₂SO₄)-?m(Na₂SO₄)-?
1. Определим массу примесей в 100г. технического гидроксида натрия:
m(примесей)=m(техническогоNaOH)xω%(примесей )÷100%
m(примесей) =100г.×20%÷100%=20г.
2. Определим массу чистого гидроксида натрия:
m(NaOH)=m(технического NaOH)-m(примесей)
m(NaOH)=100г.-20г.=80г.
3. Молярная масса гидроксида натрия:
M(NaOH)=23+16+1=40 г./моль
4. Количество вещества гидроксида натрия в 80г.:
n₁(NaOH)=m(NaOH)÷M(NaOH)
n₁(NaOH)=80г.÷40г./моль=2моль
5. 2NaOH+H₂SO₄=Na₂SO₄+2H₂O
по уравнению реакции:
n(NaOH)=2моль n(H₂SO₄)=1моль n(Na₂SO₄)=1моль
по условию задачи:
n₁(NaOH)=2моль, значит и n₁(H₂SO₄)=1моль, n₁(Na₂SO₄)=1моль
6. Молярная масса серной кислоты:
М(H₂SO₄) =2+32+64=98г./моль
7. Масса серной кислоты количеством вещества 1моль:
m(H₂SO₄)=n₁(H₂SO₄)хМ(H₂SO₄)
m(H₂SO₄)=1мольх98г./моль=98г
8. Молярная масса сульфата натрия:
M(Na₂SO₄)=46+32+64=142г./моль
9. Масса сульфата натрия количеством вещества 1моль:
m(Na₂SO₄)=n₁(Na₂SO₄)хM(Na₂SO₄)
m(Na₂SO₄)=1мольх142г./моль=142г
10. ответ: для взаимодействия с техническим гидроксидом натрия 100г. с примесью 20% потребуется 98г. серной кислоты и образуется 142г.сульфата натрия.
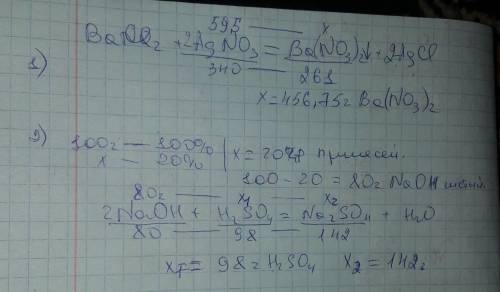
Попытка записать оба вещества в одну реакцию.
Получается примерно так:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида.
А в приведенном уравнении предполагается, что их равное количество.
Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны.
Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
ZnSO4 + Ba(NO3)2 = BaSO4 + Zn(NO3)2
Zn(2+) + SO4(2-) + Ba(2+) + 2NO3(-) = BaSO4 + Zn(2+) + 2NO3(-)
SO4(2-) + Ba(2+) = BaSO4
Mg(NO3)2 + 2NaOH = 2NaNO3 + Mg(OH)2
Mg(2+) + 2NO3(-) + 2Na(+) + 2OH(-) = 2NO3(-) + 2Na(+) + Mg(OH)2
Mg(2+) + 2OH(-) = Mg(OH)2
2K3PO4 + 3CaCl2 = Ca3(PO4)2 + 6KCl
6K(+) + 2PO4(3-) + 3Ca(2+) + 6Cl(-) = Ca3(PO4)2 + 6K(+) + 6Cl(-)
2PO4(3-) + 3Ca(2+) = Ca3(PO4)2
K2CO3 + H2SO4 = CO2 + H2O + K2SO4
2K(+) + CO3(2-) + 2H(+) + SO4(2-) = CO2 + H2O + 2K(+) + SO4(2-)
CO3(2-) + 2H(+) = CO2 + H2O
2KOH + H2SO4 = K2SO4 + 2H2O
2K(+) + 2OH(-) + 2H(+) + SO4(2-) = 2K(+) + SO4(2-) + H2O
2OH(-) + 2H(+) = 2H2O
KCl c разбавленной серной кислотой реагировать не будет.
KNO3 тоже.
Zn2+ + 2OH- = Zn(OH)2
Zn2+ 2Cl- + 2K+ + 2OH- = Zn(OH)2 + 2K+ + 2Cl-
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl
2H+ + SO3(2-) = H2O + SO2
2H+ + 2Cl- + 2K+ + SO3(2-) = H2O + SO2 + 2K+ + 2Cl-
2HCl + K2SO3 = H2O + SO2 + 2KCl
3Mg2+ 2PO4(3-) = Mg3(PO4)2
3Mg2+ 6Cl- + 6K+ + 2PO4(3-) = Mg3(PO4)2 + 6K+ + 6Cl-
3MgCl2 + 2K3PO4 = Mg3(PO4)2 + 6KCl