Химические свойства. Этан вступает в типичные реакции алканов, прежде всего реакции замещения, проходящие по свободнорадикальному механизму. Среди химических свойства этана можно выделить: термическое дегидрирование при 550-650 °C с образованием этилена;
Галогенирование этана проходит поэтапно – за один этап замещается не более одного атома водорода.
Разложение этана (и метана) проводят при температуре больше 1200 градусов: C2H6 ---> 3H2 + 2C. Кстати, именно так промышленным получают высококачественную сажу, необходимую для производства "чёрной" (автомобильной) резины.
Окисление этана. Этан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.)
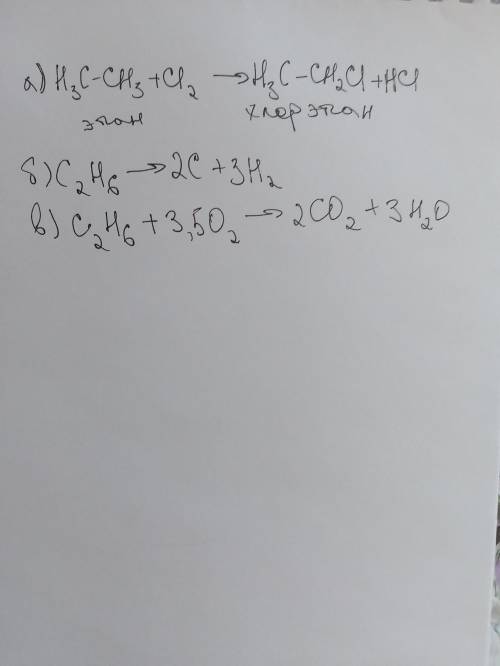
Р2О5-кислотный оксид,поэтому:
1.При взаимодействии с водой он дает кислоту:
P2O5+3H2O=2H3PO4
2.Взаимодействует со щелочами:
6KOH+P2O5=2K3PO4+3H2O
3.Взаимодействует с основными оксидами:
3Na2O+P2O5=2Na3PO4