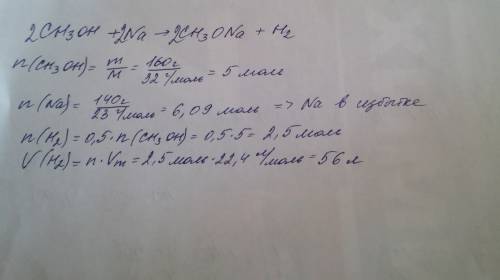
Дано:
m(известняка)-350 Кг
W(примесей)-10% или 0.1
Vm-22.4 Л/моль При н.у.
Найти:
V(co2)-?
3.15Кмоль Х
Caco3+2Hno3=Ca(no3)2+co2+h2o
1 1
W(Caco3)=1-W(примесей)=1-0.1=0.9
находим массу чистого Caco3 т.к. примеси не реагируют
W=m(вещества) / m(смеси,раствора или сплава)
m(Caco3)=m(смеси)*W(CaCo3)=350*0.9=315 Кг
n(Caco3)=m / M=315 / 100=3.15 Кмоль
по пропорции X=3.15 Кмоль т.е. n(Co2)=3.15 Кмоль
V(Co2)=n*Vm=3.15 *22.4=70.56 M3(Куб. метров.)
взаимодействие с бромной водой - качественная реакция присоединения на непредельные УВ.
C2H4 + Br2 (aqv) -> C2H4Br2
C2H6 + Br2 (aqv) -> X (реакция не идёт)
Дано: V (C2H4 + C2H6) = 200 мл.
m Br2 (aqv) = 25 г.
ω Br2 = 3,2 % = 0,032
Найти: ω C2H6
Решение:
1) m Br2 (чист) = m р-ра * ω = 25 * 0,032 = 0,8 г.
2) n Br2 = m : M = 0,8 : (80*2) = 0,8 : 160 = 0,005 моль.
3) n Br2 : n C2H4 = 1:1 => n C2H4 = 0,005 моль.
4) V C2H4 = n * Vm = 0,005 * 22,4 = 0,112 мл
5) ω = V C2H4 : V смеси * 100 % = 0,112 : 200 * 100% = 0,056 %
ответ: ω = 0,056 %.
Честно сказать, странные цифры получились. Обычно такие мелкие значения для учебников не дают. Но в решении своём я уверен. Может, в условии задачи опечатались?