512 г х л
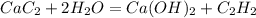
64 г 22,4 л
1. Определим теоретически возможный объем ацетилена:
при взаимодействии 64 г карбида выделяется 22,4 л ацетилена, а
при --//--//-- 512 г__________________х л, откуда
х=512*22,4/64=179,2 л
2. Если теоретический выход 179, 2 л - это 100%, а
фактический 134,4_____у %, откуда у=134,4*100/179,2=75%
5 м в кубе х м в кубе
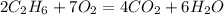
2 объема 7 объемов
1.Согласно уравнения и закона объемных отношений газов найдем объем кислорода:
для полного сжигания 2 объемов этана необходимо 7 объемов кислорода, а
для --//--//-- 5 м в кубе________________х м в кубе, откуда
х=5*7/2=17,5 м в кубе
2. Учитывая,что оббъемная доля кислорода в воздухе всего 21%,тогда:
17,5 м в кубе - это 21%, а
у м в кубе воздуха - 100%, откуда у=17,5*100/21=приблизительно 83 м в кубе
А теперь попробуй решить задание сама,вторая задача подобная(один к одному), а уравнение реакции будет такое^
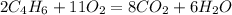
2) 2NaOH + H₂SO₄ = Na₂SO₄ + 2H₂O
3) Zn + 2NaOH = Na₂ZnO₂ + H₂
4) K₂O + H₂O = 2KOH
5) SO₂ + 2NaOH = Na₂SO₃ + H₂O
6) SO₂ + H₂O = H₂SO₃
7) FeCl₂ + 2NaOH = Fe(OH)₂ + 2NaCl
8) FeCl₂ + Zn = ZnCl₂ + Fe
9) FeCl₂ +Na₂S = FeS + 2NaCl
10) Na₂S + 3H₂SO₄ = SO₂ + 2NaHSO₄ + S + 2H₂O
11) Zn + H₂O = ZnO + H₂
12) K₂O + SO₂ = K₂SO₃