правельный ответ 4, т.к. давление относится к газам; понижая t, уменьшается скорость хим. реакции; концентрация относится к жидкостям)
200 грамм
Объяснение:
CH ≡ CH + 2Br2 → CHBr2 — CHBr2
v(C2H2) = 0.448 л
n(C2H2) = 0.448 : 22.4 = 0.02 моль
По реакции моли ацетилена и брома относятся как 1 к 2, а по задаче мы выяснили, что 0.02 моль ацетилена вступают в реакцию с X молями брома. Из этого следует, что :
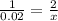
x= 0.04 моль Br2 реагирует с 0.02 молями C2H2
n(Br2) = 0.04 моль
m(Br2) = 0.04 × 160 = 6.4 грамм Br2.
Теперь переходим к раствору
w(р-ра) = 3.2% или 3.2 ÷ 100= 0.032 это массовая доля
m1(Br2) = 6.4 грамм
m(р-ра) = Х
Составляем уравнение:
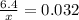
x= 200 грамм
Значит для обесцвечивания ацетилена объемом 0.448 литром, нам понадобилось 200 грамм 3.2% раствора бромной воды
Если будут вопросы, то можете отписать в комментариях.
1. Зависимость скорости хим.реакции от концентрации реагирующих веществ в наибольшей мере справедлив для реакций, протекающих
1) между твердым ивеществами
2) между газами и твердыми веществами
3) между растворами и твердыми веществами
4) между растворами веществ
2. При комнатной температуре с наибольшей скоростью проходит хим.реакция между водой и
1) барием 2) цинком 3) медью 4) кальцием
3. С наибольшей скоростью с кислородом при комнатной темп. реагирует
1) Sn 2) Al 3) Ca 4)Mn
4. При обычных условиях с наибольшей скоростью протекает хим. реакция, схема которой
1) Al + H2SO4 (разб) --> 2) 1) Al + H2SO4 (конц) --> 3) Al2О3 + KOH (р-р) --> 4) 3) AlCl3(р-р) + KOH (р-р) -->
6. При увеличении температуры на каждые 10 град. скорость большинства реакций
1) увел. в 2-4 раза
2) увеличивается в 10 раз
3) увеличивается в 100 раз
4)не изменяется
7. Если температурный коэффициент химической реакции 2, тогла при повышении температуры от 20 град. по С до 50 град. по С скорсоть реакции
1) увел в 8
2) умен в 2
3) умен в 4
4) увел в 6