2Ca3(PO4)2 + 10C + 3SiO2 = 3Ca2SiO4 + 4P + 10CO
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
3ZnSO4 + 2H3PO4 = Zn3(PO4)2↓ + 3H2SO4
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3
ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. Приведем примеры.
Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями). Следующие уравнения учащийся приводит по желанию:
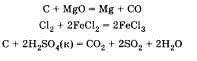
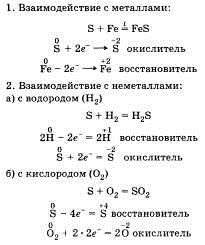

2Ca3(PO4)2 + 10C + 3SiO2 = 3Ca2SiO4 + 4P + 10CO
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
3ZnSO4 + 2H3PO4 = Zn3(PO4)2↓ + 3H2SO4
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3
Что знаю.. :3