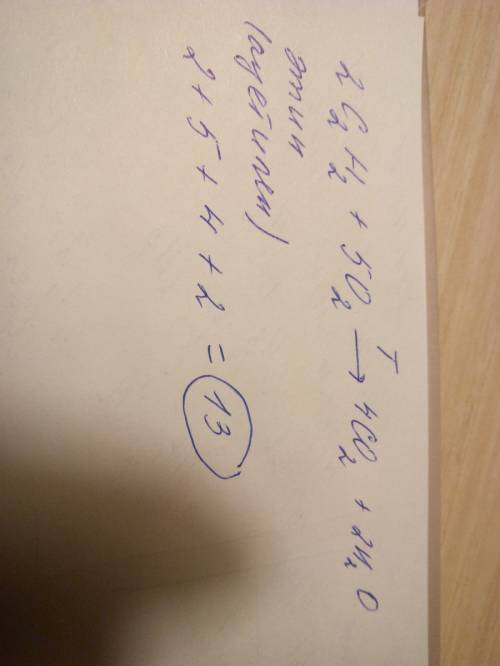
1. АгрЕгатное состояние сахара -твердое, алюминия -твердое, спирта -жидкое при нормальных условиях.
2. Сахар -белый, алюминий -металлический серый, спирт бесцветный
3Спирт горький и жжется, алюминий имеет металлический привкус, а сахар сладкий
4 алюминий имеет характерный металлический запах при соприкосновении с человеческой кожей (а так запаха не имеет), сахар запаха не имеет, спирт имеет характерный для спирта запах
5 Теплопроводность алюминия зависит от его сплава (укажи мне, какой сплав тебе нужен). теплопроводность остальных веществ смотри в учебнике по физике, кстати, там же алюминий есть. просто иначе тебя учитель спалит, что ты с сайтов списывал.
6Алюминий электропроводный, сахар почти не проводит ток, спирт хорошо проводит ток.
8 уточни, что ты имел ввиду под "Нагмачиваемость"
9 что ты имеешь ввиду под светом? уточни !
Объяснение:
если тебе нужна по общей и неорганической химии с темами, дз, шпоры, материалы, доп материалы, видосы и тд), то пиши на bezumnuy_chimic майл ру нахаляву)
1) Порядковый номер элемента показывает:
- заряд ядра атома
- число протонов и электронов
2) Номер периода говорит нам о количестве энергетических уровней
3) Номер группы дает нам информацию о числе электронов на внешнем уровне
K - калий, №19, 4 период, 1 группа, гл. подгруппа.
+19 ) ) ) ) число элетронов = числу протонов = № элемента = 19, 4 период = 4
2 8 8 1 уровня ,1 группа = 1 элетрон на внешнем уровне
Cl - хлор, №17, 3 период, 7 группа, гл. погруппа
+17 ) ) ) число электронов = числу протонов = № эл - та = 17, 3 пер. = 3 уровня,
2 8 7 7 группа - 7 внешних электронов
Mn - марганец(тут по - хлеще дело будет) №25, 4 период, 7 группа, побочная подгруппа, вот из-за того, что марганец находится в побочной подгруппе распределение электронов будет несколько иным, по сравнению с предыдущими примерами, смотрим:
+25 ) ) ) ) ne(число эл-в) = np(число пр - в) = № эл. = 25, 4 пер. = 4 уровня
2 8 13 2 7 группа = ...БАХ! 2 электрона (вот о чем я говорил когда только начал характеризовать атом марганца)
По многочисленным заявкам характеристики фосфора и кальция
Начнем с фосфора:
P №15, 3 период, 5 группа, главная подгруппа;
+15 ) ) )
2 8 5
Электронная формула атома: 1s2 2s2 2p6 3s2 3p3
Фосфор - типичный неметалл
Характерные степени окисления атома фосфора: +5, +3, 0, -3
Высший оксид фосфора P2O5 - кислотный характер
Гидроксид - H3PO4 -фосфорная кислота
Летучее водородное соединение PH3 - фосфин
Теперь кальций
Ca - кальций, №20, 4 период, 2 группа, главная подгруппа;
+20 ) ) ) )
2 8 8 2
Электронная формула атома: 1s2 2s2 2p6 3s2 3p6 4s2
Кальций типичный - металл
Степени окисления: 0, +2
Высший оксид: CaO - основный характер
Летунее водородное соединение