Массовая доля (MgSO4) в (MgSO4*7H2O)=120:246=0,4878(48,78%)
тогда масса (MgSO4) в купоросе =400Х0,4878=195гр.;масса воды=400-195=205гр. какой массе 5% раствора MgSO4 содержится 195гр. соли?
195:0,05=3900гр.Но в кристаллогидрате уже имеется 205гр воды ,тогда
масса раствора=3900-205=3695гр.
Оксиды - это химические вещества, состоящие из атомов кислорода в степени окисления (-2) и атомов металлов или неметаллов.
Оксиды бывают:
1) солеобразующие (SO2, CO2)
2) несолеобразующие (CO, NO)
3) кислотные (P2O5, CO2)
4) основные (Na2O, BaO)
5) амфотерные (Al2O3, ZnO, BeO)...
1. Солеобразующие оксиды реагируют с щелочами, основными оксидами и водой.
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
P2O5+3H2O=2H3PO4
2. Несолеобразующие оксиды хорошие восстановители
CO+[Ag(NH3)2]OH+NaOH=Ag+Na2CO3+NH4CO3+H2O
3. Кислотные оксиды реагируют с щелочами, основаниями, водой (см. 1)
4. Основные оксиды реагируют с кислотами, кислотными оксидами и водой
Na2O+3HCl=2NaCl+H2O
Na2O+SO2=Na2SO3
Na2O+H2O=2NaOH
5. Амфотерные оксиды проявляют и свойства кислотных, и свойства основных
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+NaOH=NaAlO2+H2O (сплавление)
Al2O3+6NaOH+3H2O=2Na3[Al(OH)6]+H2
Al2O3+P2O5=2AlPO4
Al2O3+Na2O=2NaAlO2
Объяснение:
Применение же оксиды находят в самых разных сферах. Начиная от металлургии и заканчивая фармацевтикой. Некоторые из них опасны. Например, СО (угарный газ). Он препятствует попаданию кислорода в лёгкие, связываясь с гемоглобином крови. И человек засыпает, потом умирает, если вовремя не вынести его на свежий воздух.
С гидроксидом лития:
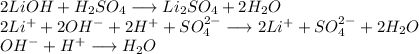
Признак протекания реакции: отсутствуют.
C медью (если кислота концентрированная):
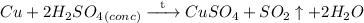
Это окислительно-восстановительная реакция, не ионного обмена, поэтому ионного уравнения нет.
Признак протекания реакции: раствор приобретает голубой оттенок (за счет образования сульфата меди (II)). Выделяется газ с характерным резким запахом - запах загорающейся спички (сернистый газ). Происходит растворение металла (меди).
С хромом:
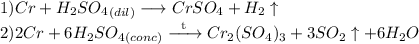
Обе реакции окислительно-восстановительные, не ионного обмена, поэтому ионных уравнений нет.
В первом случае, если кислота разбавленная. признак протекания реакции: раствор приобретает голубой оттенок (за счет образования сульфата хрома (II)).
Во втором случае, если кислота концентрированная. признак протекания реакции: раствор приобретает зеленоватый оттенок (за счет образования сульфата хрома (III)). Выделяется сернистый газ, имеющий характерный резкий запах загорающейся спички.
С карбонатом натрия:
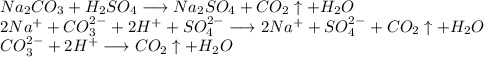
Признак протекания реакции: отсутствуют.
С гидроксидом железа (III):
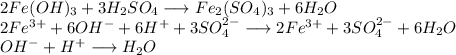
Признак протекания реакции: раствор приобретает желтоватый оттенок (за счет образования сульфата железа (III)). Происходит растворение осадка (гидроксида железа (III)).
С оксидом магния:
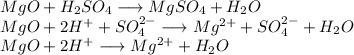
Признак протекания реакции: отсутствуют.
С бромоводородной кислотой (если обе кислоты концентрированные):
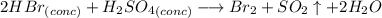
Это окислительно-восстановительная реакция, не ионного обмена, поэтому ионного уравнения нет.
Признак протекания реакции: выделяется газ с характерным запахом загорающейся спички. Раствор приобретает красно-бурый цвет (за счет образования брома). Также бром имеет едкий запах (что-то между хлором и йодом).
массовая доля (MgSO4) в (MgSO4*7H2O)=120:246=0,4878(48,78%)
тогда масса (MgSO4) в купоросе =400Х0,4878=195гр.;масса воды=400-195=205гр.
Зададим себе вопрос: в какой массе 5% раствора MgSO4 содержится 195гр. соли?
195:0,05=3900гр.Но в кристаллогидрате уже имеется 205гр воды ,тогда
масса раствора=3900-205=3695гр.