Один из получения кислорода в лаборатории – разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды.
Объяснение:
ВЫВОД:
Образец отчета о проделанной практической работе
Выполняемые операции
(что делали)
Рисунки с обозначениями исходных и полученных веществ
Наблюдения.
Условия
проведения реакций. Уравнения реакций
Объяснения наблюдений.
Выводы
Сборка прибора для получения кислорода.
Проверка прибора на герметичность
Выделяются пузырьки воздуха
Прибор собран герметично
Получение кислорода из KMnO4
при нагревании
При нагревании KMnO4происходит реакция:
О2 получают в лаборатории разложением KMnO4 при нагревании
Доказательство получения кислорода при
тлеющей лучинки
Тлеющая лучинка
(уголь) ярко загорается
в О2
Полученный газ О2поддерживает горение
Характеристика
физических свойств О2. Собирание О2 двумя методами:
вытеснением воздуха (а),
вытеснением воды (б)
Кислород вытесняет воздух и воду из сосудов
Кислород – газ без цвета и запаха,
немного тяжелее воздуха, поэтому
его собирают в сосуд, поставленный на дно. Кислород малорастворимый в воде
Характеристика химических свойств О2. Взаимодействие с простыми веществами: горение угля.
Раскаленный уголек ярко горит в О2:
Известковая вода мутнеет, т. к. образуется нерастворимый в воде осадок СaСО3:
СО2 + Са(ОН)2 СaСО3 + H2O.
Объяснение:
Задани №1 :
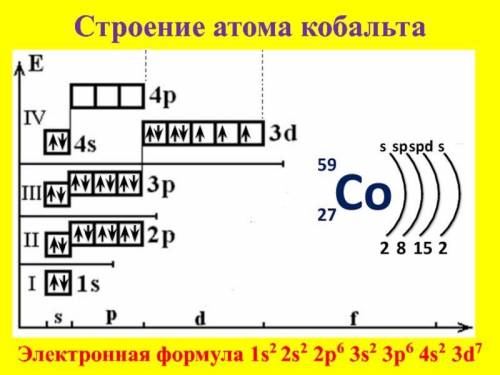
Электронная формула атома: Co - 1s²2s²2p⁶3s²3p⁶4s²3d⁷
Электронно-графическая формула и схема строения элемента показана внизу: ↓
семейству элементов относится кобальт - это d-элементов
Задание №2
1) Li₂O + H₂O → 2LiOH
2) 3LiOH + H₃PO₄ → Li₃PO₄↓ + 3H₂O
3) 2Li₃PO₄ + 3H₂SO₄ → 3Li₂SO₄ + 2H₃PO₄
Задание №3
K⁺I⁻ + Cl₂⁰ + H₂⁺O⁻² → K⁺I⁺⁵О₃⁻² + H⁺Cl⁻
I⁻ - 6e⁻ → I⁺⁵ | 6 | | 1 | - восстановитель (окисление)
| 6 |
Cl₂⁰ + 2e⁻ → 2Cl⁻ | 2 | | 3 | - окислитель (восстановление)
----------------------------------------------------------------------------------------------
Получается:
KI + 3Cl₂ + 3H₂O → KIO₃ + 6HCl
Задание №4
3BaBr₂ + 2K₃PO₄ → Ba₃(PO₄)₂↓ + 6KBr - молекулярное уравнение
3Ba²⁺ + 6Br⁻ + 6K⁺ + 3PO₄³⁻ → Ba₃(PO₄)₂↓ + 6K⁺ + 6Br⁻ - полное ионное уравнение
3Ba²⁺ + 3PO₄³⁻ → Ba₃(PO₄)₂↓ - сокращенное ионное уравнение
Задание №5
H₂C=C=CH-CH₃ - Бутадиен-1,2
Химические реакции:
1) Гидрирование:
H₂C=C=CH-CH₃ + H₂ (Ni) → H₃C-CH=CH-CH₃
бутадиен-1,2 + водород (никель) → бутен-2
2) Гидрогалогенирование
H₂C=C=CH-CH₃ + HCl → H₃C-C(Cl)=CH-CH₃
бутадиен-1,2 + соляная кислота → 2-хлорбутен-2
Задание №6
бутилового эфира метановой кислоты - H₃C-CH₂-CH₂-CH₂-O-COH
Получение:
1) Этерификация:
HCOOH + HO-CH₂-CH₂-CH₂-CH₃ (H₂SO₄) → H₃C-CH₂-CH₂-CH₂-O-COH + H₂O
муравьиная кислота + бутанол-1 (серная кислота) → бутиловый эфир муравьиной кислоты + вода
2) Алкилирование солей:
HCOONa + Cl-CH₂-CH₂-CH₂-CH₃ → H₃C-CH₂-CH₂-CH₂-O-COH + NaCl
формиат натрия + 1-хлорбутан → бутиловый эфир муравьиной кислоты + поваренная соль
Задание №7
Дано:
V(газа) = 11,2 л
-----------------------------
Найти:
m(C₂H₅NH₂) - ?
1) Запишем уравнение сгорания этиламина:
x - моль 2x - моль x/2 - моль
4C₂H₅NH₂ + 15O₂ → 8CO₂↑ + 2N₂↑ + 14H₂O
2) Пусть в реакцию вступило x моль C₂H₅NH₂, тогда образовалось 2x моль CO₂, и x/2 моль N₂, если мы их сложим газообразные продукты, то мы получим 2,5x моля: n(CO₂) + n(N₂) = 2x + x/2 = 4x/2 + x/2 = 5/2x = 2,5x
3) Далее мы находим количество молей в газе:
Vm(газа) = 22,4 л/моль
n(газа) = V(газа)/Vm(газа) = 11,2 л/22,4 л/моль = 0,5 молей
4) Далее мы решим уравнение что-бы найти количество молей в этиламине:
n(газа) = n(CO₂) + n(N₂)
0,5 = 2,5x
x = 0,5/2,5
x = 0,2 ⇒ n(C₂H₅NH₂) = 0,2 моля
5) Далее сначала находим молекулярную массу этиламина, а потом мы и найдем массу этиламина:
M(C₂H₅NH₂) = 12×2+1×5+14+1×2 = 24+5+14+2 = 45 гр/моль
m(C₂H₅NH₂) = n(C₂H₅NH₂) × M(C₂H₅NH₂) = 0,2 моль × 45 гр/моль = 9 гр
ответ: m(C₂H₅NH₂) = 9 гр
Задание №8
Дано:
V(р-ра) = 100 мл
ω(HNO₃) = 34%
ρ(HNO₃) = 1,4 гр/мл
ω(р-ра) = 10%
-------------------------------
Найти:
m(H₂O) - ?
1) Найдем массу раствора:
m(р-ра) = V(р-ра) × ρ(HNO₃) = 100 мл × 1,4 гр/мл = 140 гр
2) Далее находим массу азотной кислоты:
m(HNO₃) = m₁(р-ра)×ω(HNO₃)/100%
m(HNO₃) = 140 гр × 34%/100% = 140 гр × 0,34 = 47,6 гр
3) Теперь решим уравнение: возьмем за х - m воды, необходимую прибавить:
m(HNO₃)/(m(р-ра) + x) = ω(р-ра)/100%
47,6/(140 + х) = 10/100
47,6/(140 + х) = 0,1 | × (140 + х)
47,6 = 14 + 0,1x
-0,1x = 14 - 47,6
-0,1x = -33,6
x = -33,6/-0,1
x = 336 гр ⇒ m(воды) = 336 гр = 336 мл
ответ: m(воды) = 336 гр = 336 мл